网站维护
系统内容更新/升级中

在有机化学合成中,我们会遇到同一个底物在不同的反应条件下,经不同的反应机理生成不同主产物的情况。如图1所示,通过酰肼化合物1与异硫氰酸酯反应或者通过羧酸化合物3与肼碳硫酰胺类化合物缩合,可以很方便的生成共用中间体2。从化合物2出发,分别经酸性、碱性、中性条件得到噻二唑、三氮唑、噁二唑等五元杂环化合物[1,2,3]。本章节我们用QM方法探讨分析这些五元杂环的构建机理。
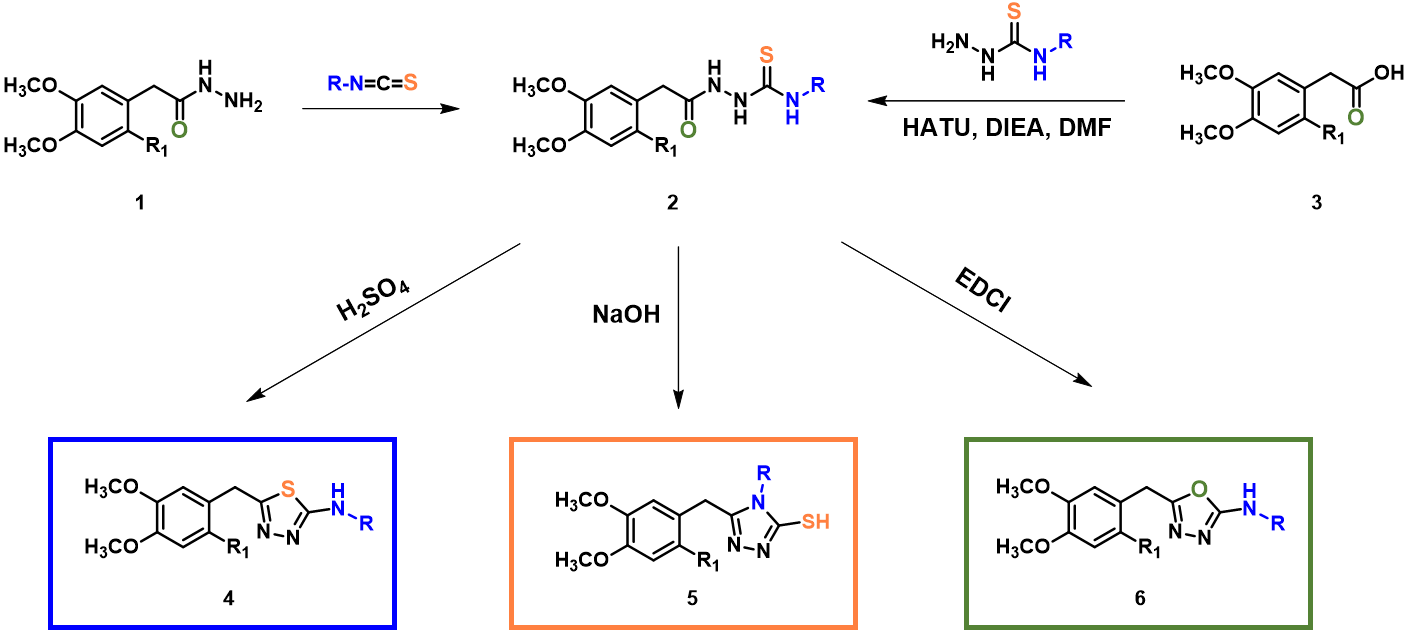
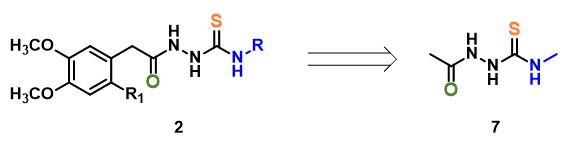
我们知道,在进行计算设置时需要根据反应体系找到实际发生反应的关键中间体作为计算对象,设置所需参数,来进行分析探讨(第三十一章),接下来我们会分别考察三种不同体系的反应情况。
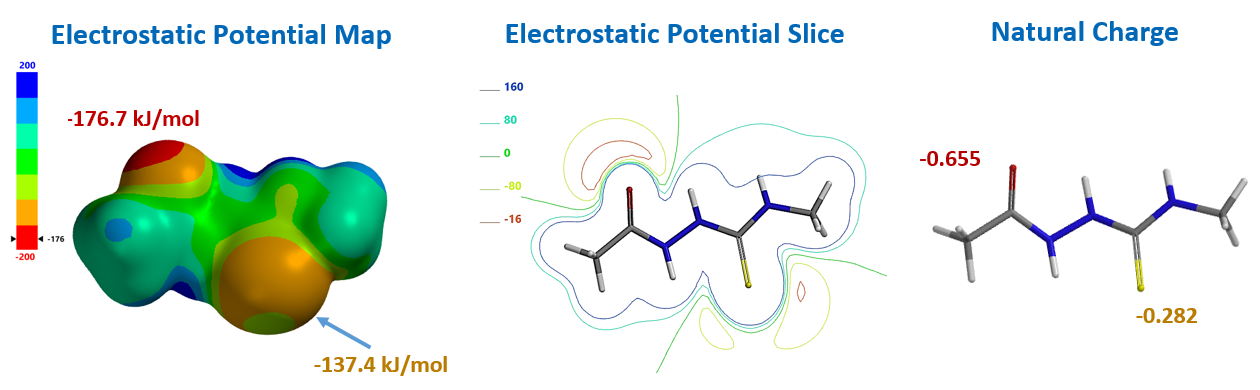
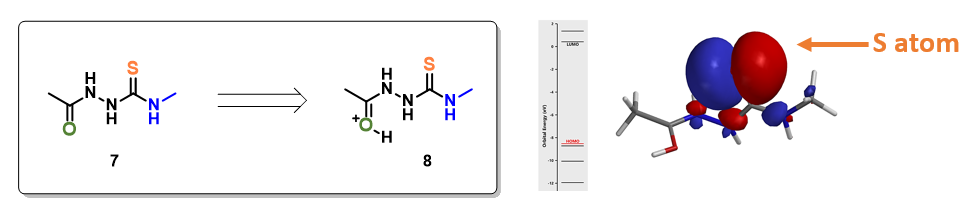
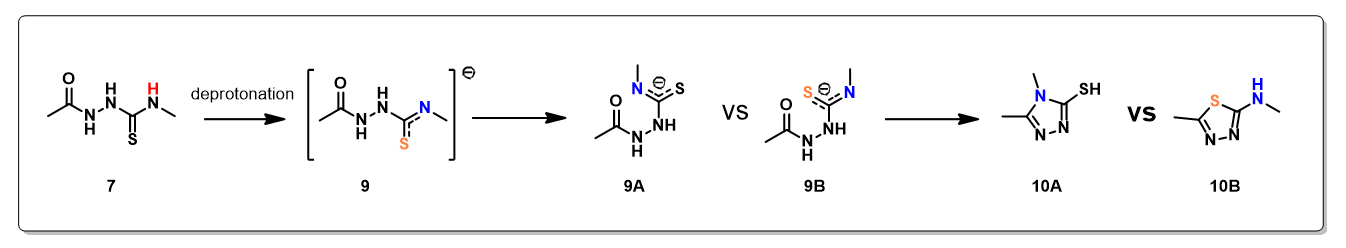
第一步,先找到化合物7碱性最强的点,即最易被质子化的位点。在QM计算中,有多种参数可以用来考察化合物各位点的碱性情况,这里我们选用静电势(Electrostatic Potential)及自然电荷数(Natural charge)来分析分子各个位点的碱性[4]。如静电势图例所示,越蓝的区域酸性越强,越红的区域碱性越强,静电势切面图(Electrostatic Potential Slice)可以更具形象化。从自然电荷数看,越负的读数位点碱性越强。由此可知羰基氧会优先质子化得到中间体8。中间体8内环合构建噻二唑类化合物的本质上是一个亲核反应,计算可知HOMO主要分布在硫原子上,即亲核能力最强的反应位点(图3)。
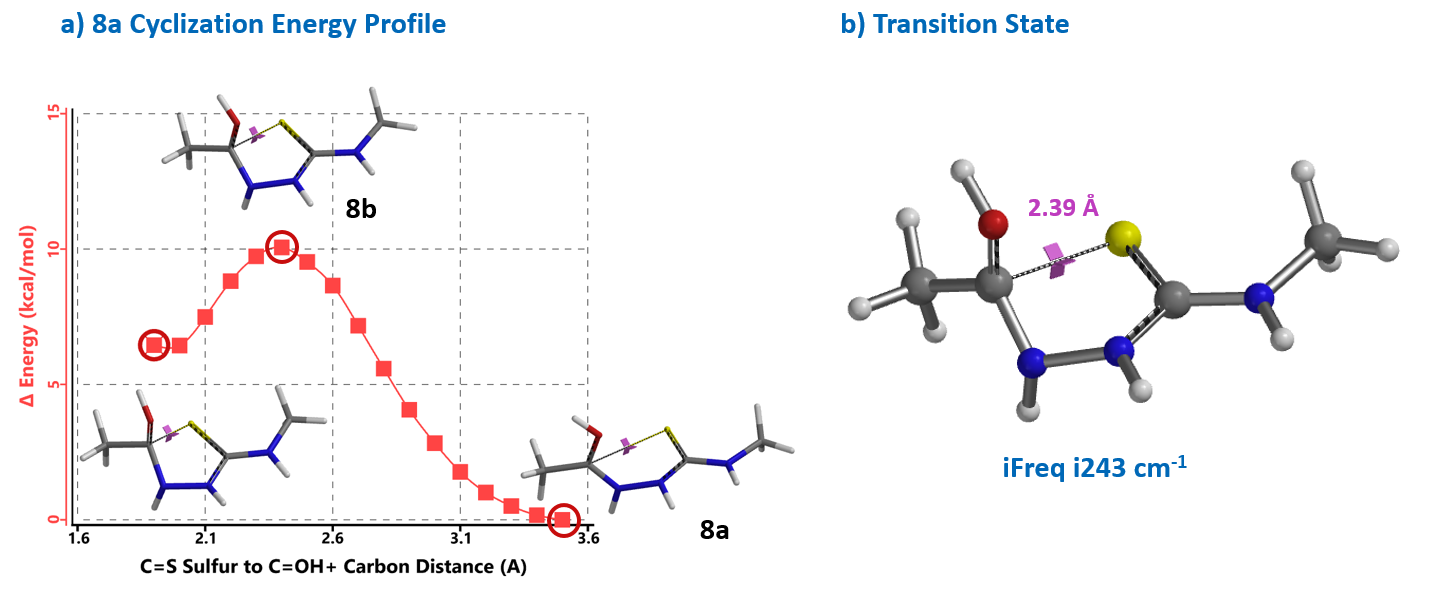
进一步计算环化步骤的活化能曲线(图4)可知反应所需能量为10 kcal/mol,温和条件即可发生反应。选取能量最高点的结构计算更加精确的过渡态能量,同时通过频率分析计算过渡态虚频。结果表明过渡态结构有且只有一个虚频为i243 cm-1,进一步表明过渡态的合理性(第二十四章)。
在碱性体系下,酸性最强的H被优先攫取生成对应的负离子中间体。从静电势图可知,硫酰胺NH酸性最强,优先被转换为N负离子,考虑到存在N-C-S三原子共轭的情况,我们同步考察硫负离子参与反应的可能性。分别计算得到活化能曲线(图5)。
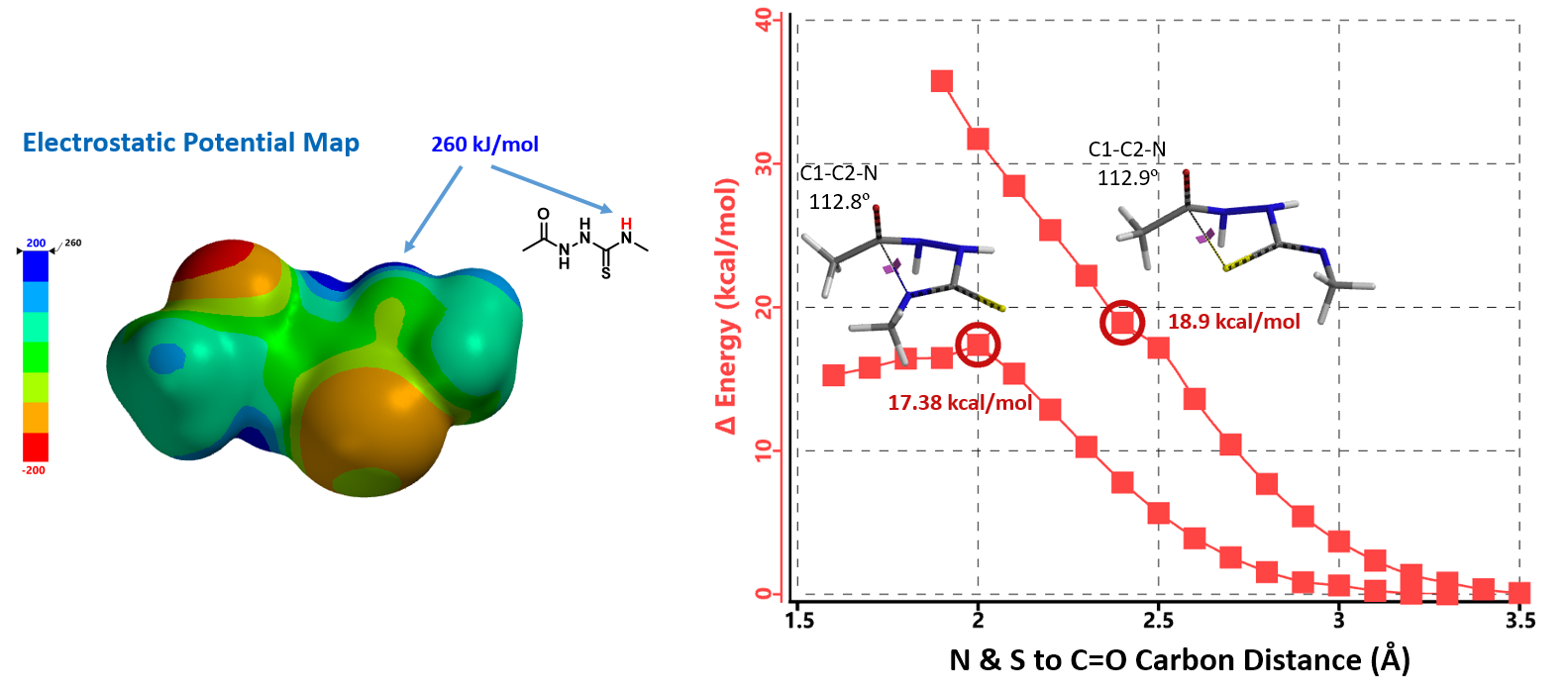
从氮负离子进攻羰基碳正离子后环合构建三氮唑类化合物所需活化能为17.38 kcal/mol,加强反应条件可以促进反应顺利发生。这与文献检索到的条目及我们项目中使用的反应条件(50 – 100 °C 加热反应)相匹配。当硫负离子参与反应去构建噻二唑环化合物时,计算得到的能量曲线是持续上升的状态,我们尝试更换多组适宜的基组/泛函设置,也得到同样的能量持续上升的结果,这表明该条件下反应不可行。在实际工作中,合成人员也没有观察到噻二唑产物生成,这与计算结果完全匹配。
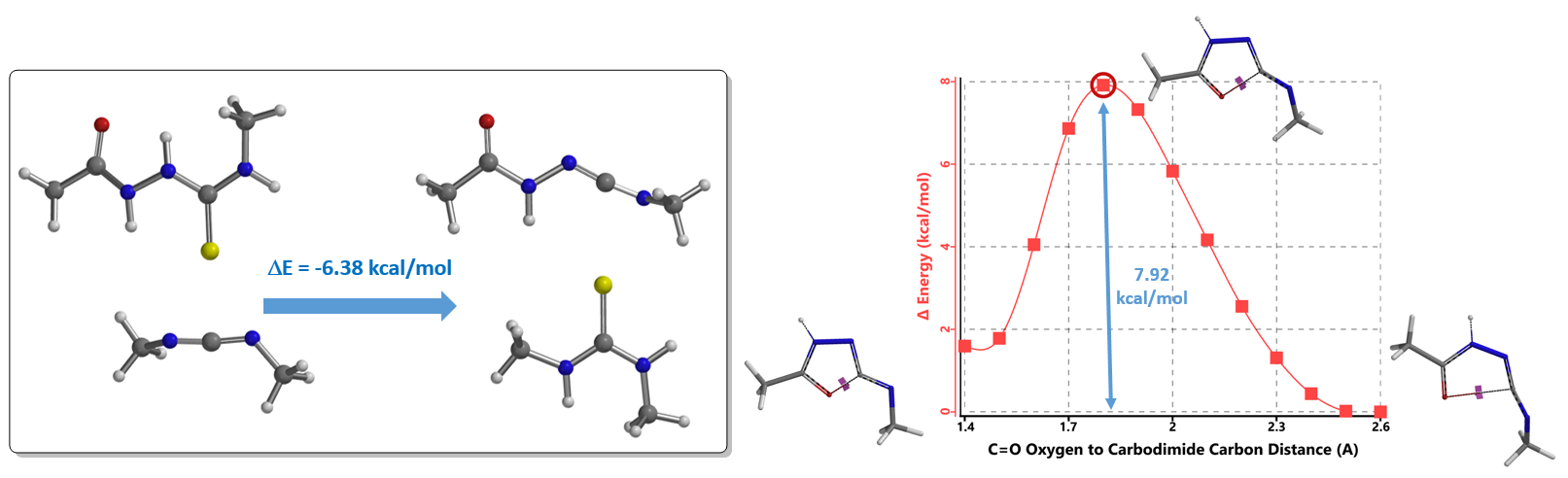
在文献可以检索到多组中性体系都可以使构建噁二唑的反应顺利进行。本文以1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDCI)体系为例,该反应分两步进行,底物7在EDCI作用下脱去一分子硫化氢,碳二亚胺结构中间体11发生环合反应得到噁二唑产物12(图6)。
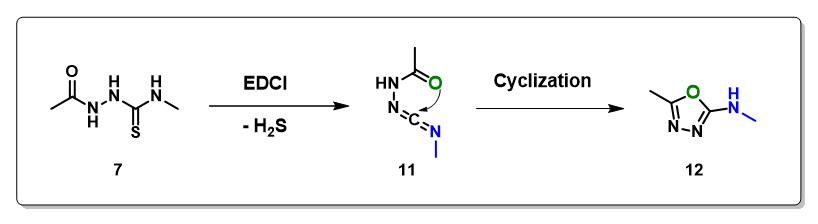
经计算,硫化氢的脱去步骤是放热反应,容易进行。环合步骤的活化能为7.92 kcal/mol,整个反应过程都比较容易发生。
根据反应机理分析,同时考虑反应环境找到实际反应物,并将其设置为计算对象,计算决速步需要的相关考核参数达到分析化学反应及预判实验结果的目的。这是我们日常工作中解决化学问题的通用流程。期待大家对更多的化学问题进行QM分析,分享探讨,共同进步!
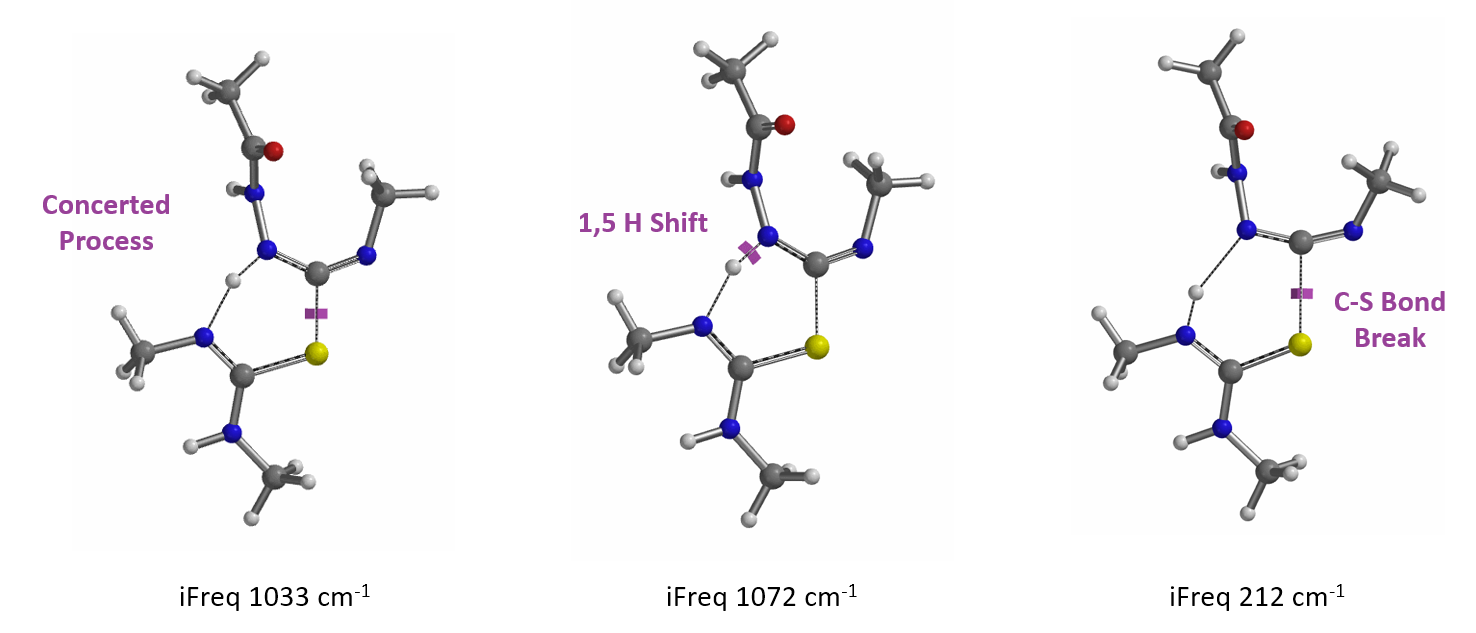
此处给各位读者留一个思考题,中性条件下构建噁二唑类化合物,请大家考察第一步脱硫化氢(图8,化合物7到11),哪个机制是更符合QM计算结果?通过环状过渡态一步到位过程,还是分步进行的呢?期待您的留言讨论。
本文由王秋月、王守亮、卫小文编撰。
参考文献:
[1] P. Zoumpoulakis, C. Camoutsis, G. Pairas, M. Sokovic, J. Glamoclija, C. Potamitis, A. Pitas, Bioorg. Med. Chem. Lett, 2012, 20, 1569.
[2] I. Saramet, A. Banciu, L. Socea, C. Draghici, M.D. Banciu, Heterocyclic Communications, 2003, 9, 653.
[3] F. Naaz, F. Ahmad, B.A. Lone, Y.R. Pokharel, N.K. Fuloria, S. Fuloria, M. Ravichandran, L. Pattabhiraman, S. Shaf, M.S. Yar, Bioorganic Chemistry, 2020, 95, 103519.
[4] Spartan’20 Tutorial and User’s Guide (2020). Irvine, CA, USA: Wavefunction, Inc. p599; A.E. Reed, R.B. Weinstock, F. Weinhold, J. Chem. Phys. 1985, 83, 735; T. Lu T, F.W. Chen, Acta Phys.-Chim. Sin. 2012, 28, 1.