网站维护
系统内容更新/升级中

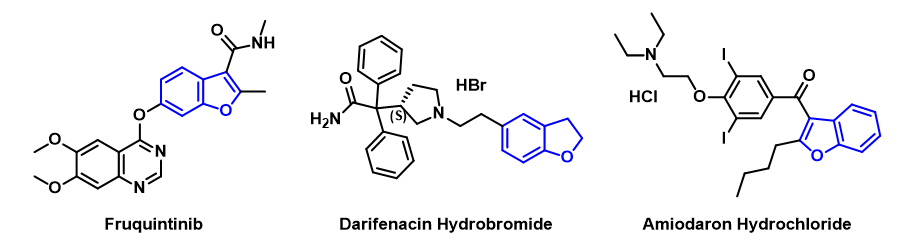
苯并呋喃环作为药物分子中一种常见骨架,其合成在药物化学中有着广泛的应用。比如:辉瑞公司研发的抗心律失常药胺碘酮,诺华公司研发的泌尿生殖系统药物氢溴酸达菲那新,和记黄埔的抗肿瘤药物呋喹替尼等(图1)[1]。
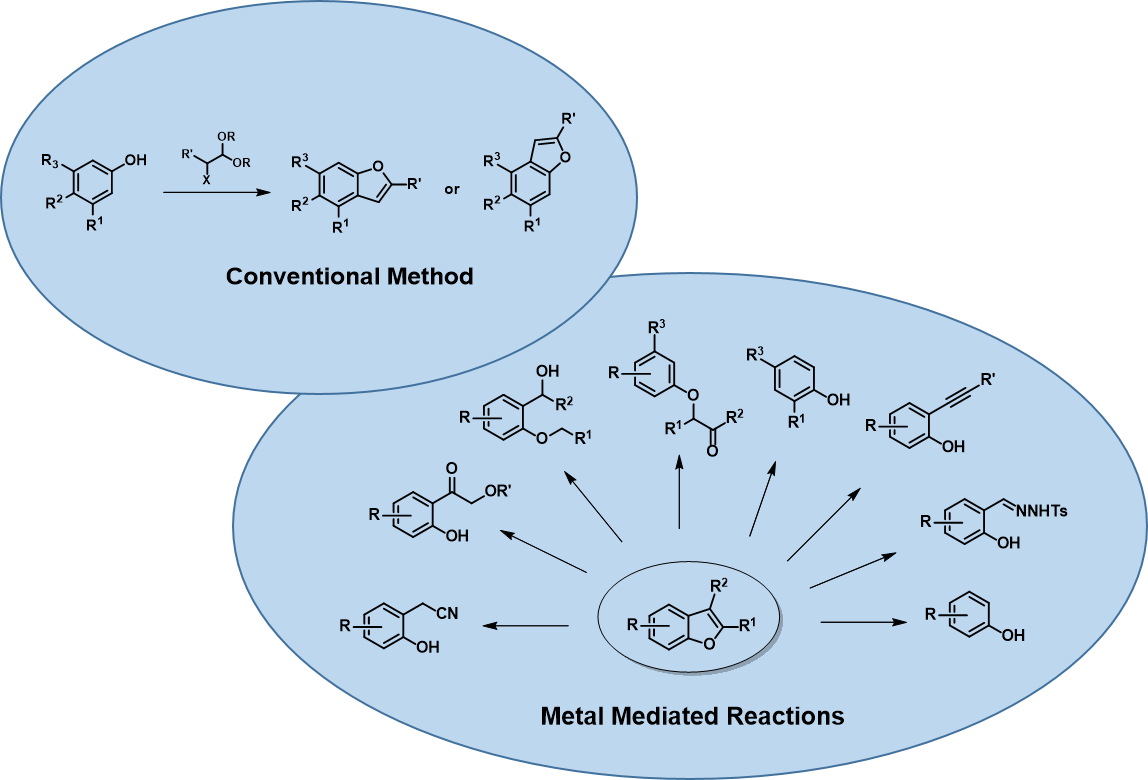
苯并呋喃结构的构建有多种方式[2],其中芳基醚化合物环化是实验室常用的合成方法之一 (图2),酸催化缩醛环化有时会存在区域选择性问题,本章就此进行探讨。
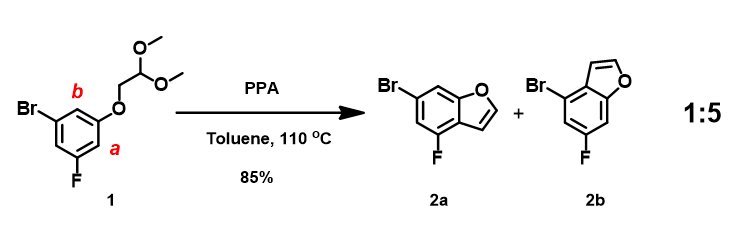
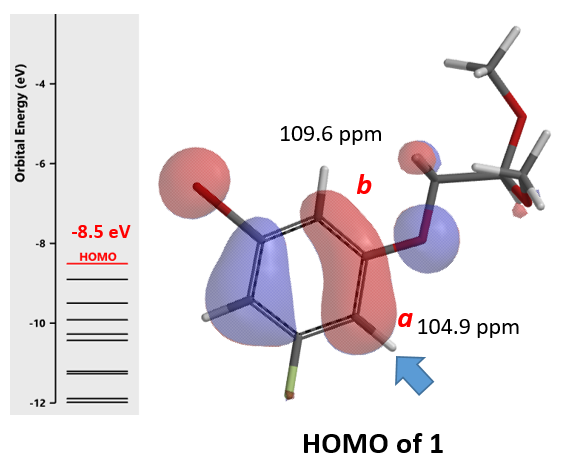
在工作中,我们有如下骨架结构需要合成(图3)。在PPA催化下,缩醛化合物1经分子内环化构建目标化合物2a。对反应底物1的结构进行初步QM考察,得到HOMO及13C NMR数据(图4)。计算结果表明,该反应很大几率会同时得到2a及2b两个位置异构体,且2a应该是主产物。但在此反应条件下,实际反应产物比为2a : 2b = 1 : 5, 2b 为主产物。当计算结果与实验数据不符时,我们需要继续剖析原因,考虑还有哪些关键的影响因素。
我们看一下反应机理,起始底物1在酸催化下质子化并脱去一个甲氧基,形成中间体A,苯环位点a或b对中间体A氧鎓离子进行亲核加成反应,生成一对区域异构的中间体B和C,随即发生消除反应得到最终产物 (图5)。
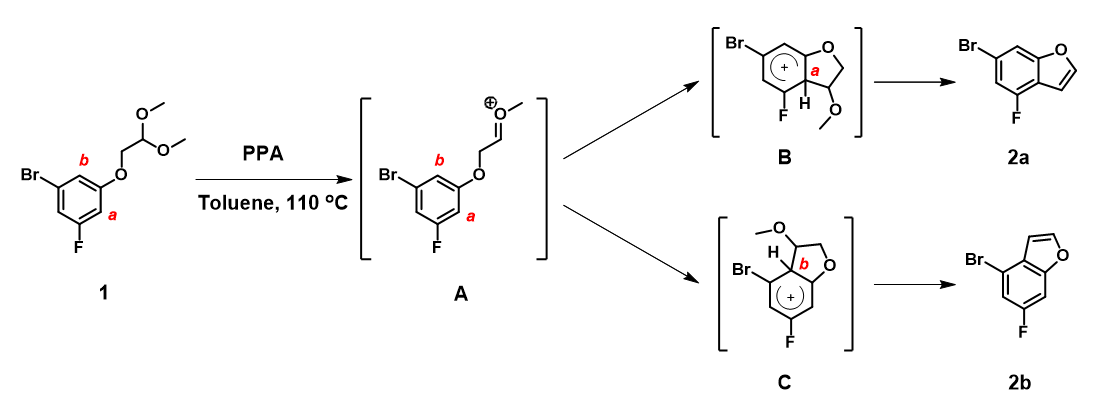
我们可以看出,相较于化合物1,中间体A才是环化过程的实际反应物, 用来考察关环反应的区域选择性更为恰当。计算重点是分析氧鎓离子的亲核反应,需要首先分析相关轨道在 a 和 b 位是否可用于环化。
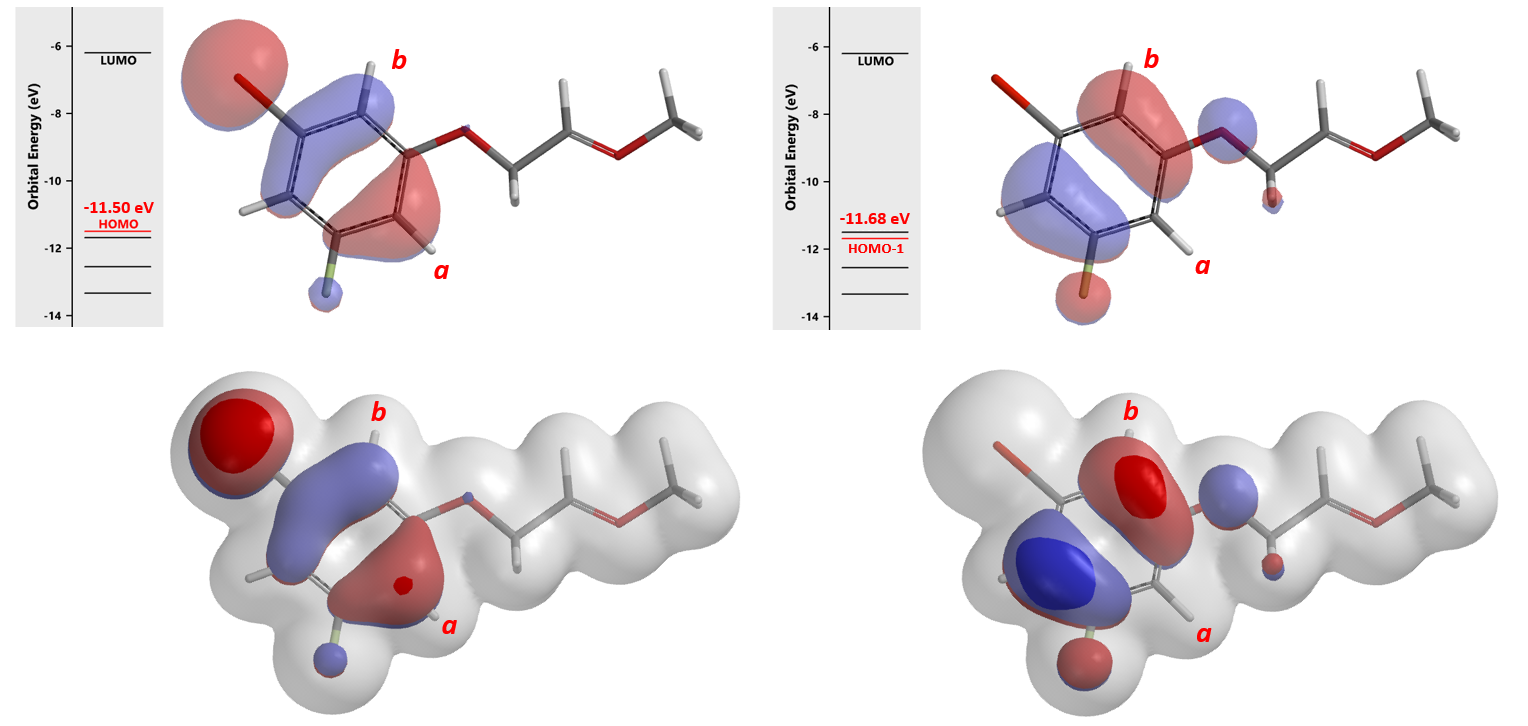
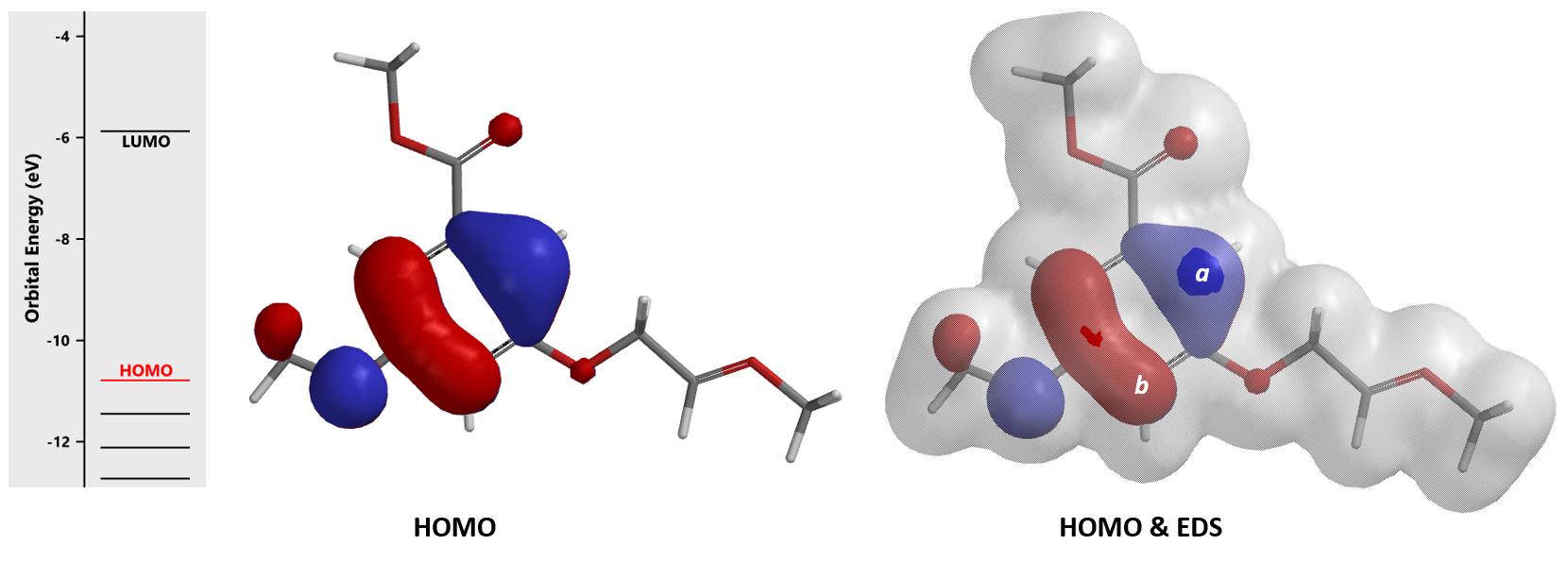
数据表明 (图6),中间体A的HOMO (-11.50 eV)与HOMO-1 (-11.68 eV) 的能级差很小,只有0.18 eV。环化使用HOMO产生2a, HOMO-1可以产生2b。我们进一步结合电子密度等值面 (Electron Density Surface, EDS)[3]参数来分析。在HOMO/HOMO-1图上叠加密度等值面, 可以看到在同样的等值面下,HOMO-1 lobe 在 b 位点比 HOMO lobe 在 a位点更易接近,这意味着在相同条件下,b位点可能更易于参与反应,优先生成2b。
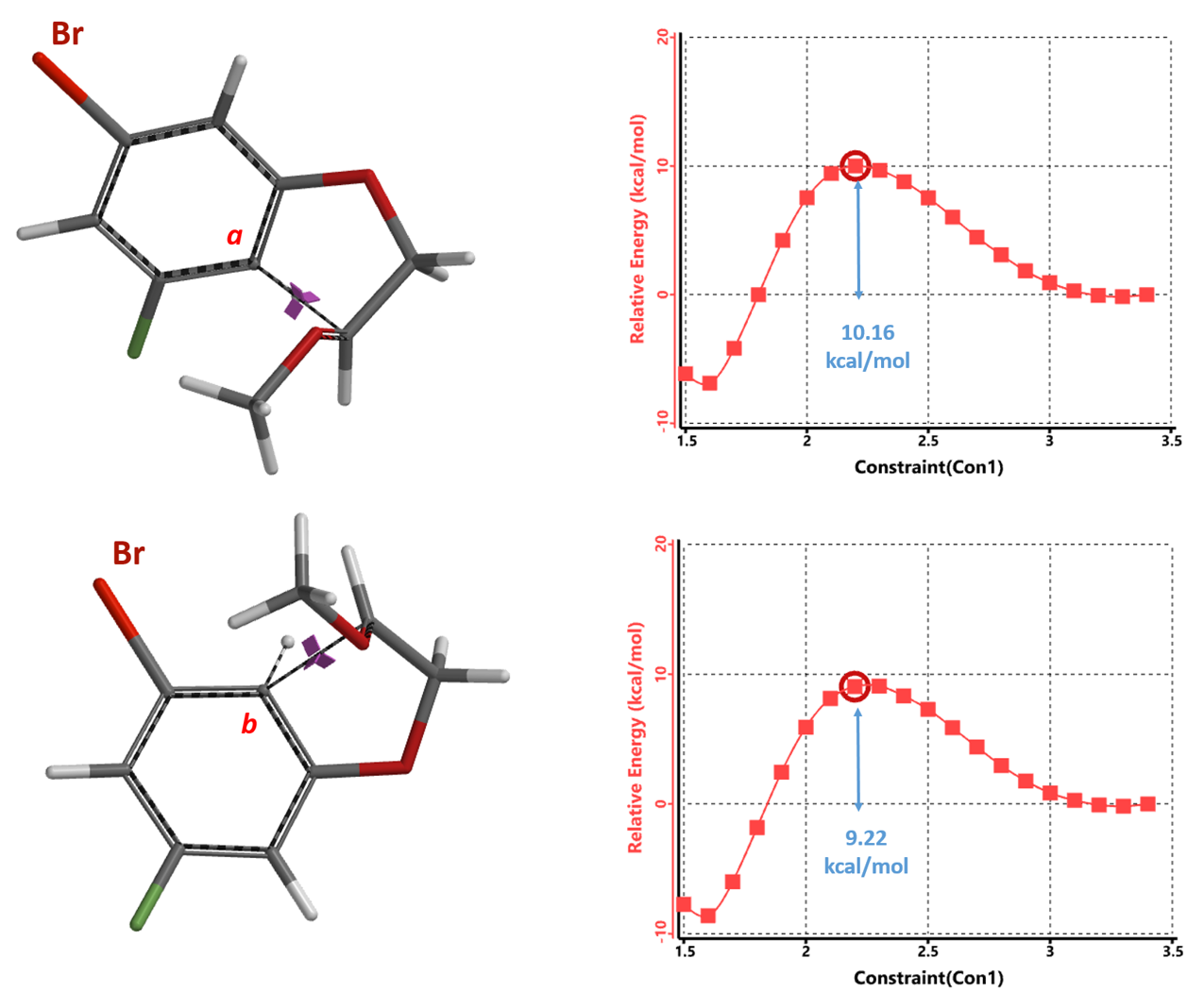
我们同时进一步计算两个区域异构体产物生成所需活化能。从图7可知,b位点发生环化反应所需活化能为9.22 kcal/mol, 相较于a位点所需10.16 kcal/mol要低0.94 kcal/mol。这和我们前序通过HOMO/HOMO-1结合EDS得出的结论是一致的。
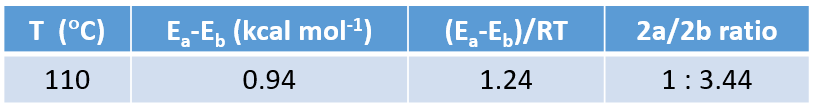
更进一步, 计算出 110 °C温度下两个产物 2a : 2b的比例约为1 : 3.44,与1:5的实验数据一致(见QM第九章)。
尽管环化反应的活化能约为10 kcal/mol,反应仍需要加热到 110 °C 才能顺利进行。我们推断加热条件对于前序的酸催化缩醛形成氧鎓离子A的步骤所需。
当我们在工作中遇到化学问题,首先要找到该反应的主要影响因素,并根据反应特性构建模型,计算所需参数;再对数据进行分析得出结论,指导实验操作。如基本计算仍存有疑惑或与实验数据不符,则需要继续剖析原因,考虑更多的影响因素,进一步计算及解析,最终答疑解惑指导工作。在此流程中的一个关键点在于要明确计算对象,这就要求我们很好的理解反应的机理,明确决速步及关键中间体,做正确而有效的计算设置。
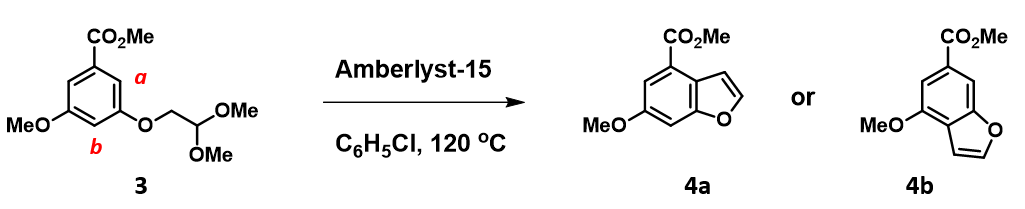
文献报道分子3的环化反应具有高度的区域选择性[4]。计算可知氧鎓盐中间体的HOMO 与 HOMO-1 轨道具有明显的能量差0.66 eV,此时我们只需要考虑HOMO,并结合密度等值面即可预测主产物为4a还是4b。你的答案是什么呢? 期待留言讨论。
本文由王秋月、郑重、王守亮、卫小文编撰。
参考文献:
[1] R.J. Nevagia, S.N. Dighe, S.N. Dighe, Eur. J. Med. Chem. 2015, 97, 561-581.
[2] A. Lavanya, K. Narasimhan, V. Padmini, Mini-Rev. Org. Chem. 2019, 17, 224–276.
[3] Spartan’20 Tutorial and User’s Guide (2020). Irvine, CA, USA: Wavefunction, Inc. p368.
电子密度等值面 (Electron Density Surface, EDS),是电子分布在三维空间上的表达方式。当等值面 >99%时,可以认为包含了分子大部分的电子,大致对应于分子的范德华表面。电子密度等值面揭示了分子的大小和形状,同时可以标识出分子位阻的作用范围,还能够和分子轨道或是静电势图重叠,用于描述分子的物理和化学性质。
[4] J-T. Liu, T.J. Do, C.J. Simmons, J.C. Lynch, W. Gu, Z.X. Ma, W. Xu, W.P. Tang, Org. Biomol. Chem. 2016, 14, 8927.