网站维护
系统内容更新/升级中

各位《QM魔法小课堂》的粉丝们,我们又开讲了。
碳酸二甲酯 (DMC) 是一种低毒、环保性能优异、用途广泛的化工原料,是重要的有机合成试剂。分子结构中含有羰基、甲基和甲氧基等官能团,可替代剧毒的光气、硫酸二甲酯等,作为甲基化或酰基化试剂使用,提高生产操作的安全性,降低环境污染。
日常工作学习中,大家习惯用软硬酸碱 (Hard-Soft-Acid-Base, HSAB) 理论理解有机化学反应现象。HSAB的概念在1963年被Pearson提出[1],“硬”是指那些具有较高电荷密度、较小半径的粒子(离子、原子、分子),即电荷密度与粒子半径的比值较大。“软”是指那些具有较低电荷密度和较大半径的粒子。“硬”粒子的极化性较低,但极性较大;“软”粒子的极化性较高,但极性较小,大体上来说,“硬亲硬,软亲软”生成的化合物较稳定。2005年,Tundo课题组发表了一篇通过HSAB来理解碳酸二甲酯作为两可亲电试剂与不同底物的反应结果的文章[2]。该理论为经验性的总结,主要应用与对配合物稳定性的判别和其反应机理的解释。然而Tundo等应用HSAB理论, 显然没有充分解释他们的实验结果, 有诸多困惑之处。2011年,Mayr等发表 “Farewell to the HSAB Treatment of Ambident Reactivity”[3],该文章倡导通过系统化的方法论 (图1),来分析两可试剂的反应选择性是由热力学还是动力学控制的。
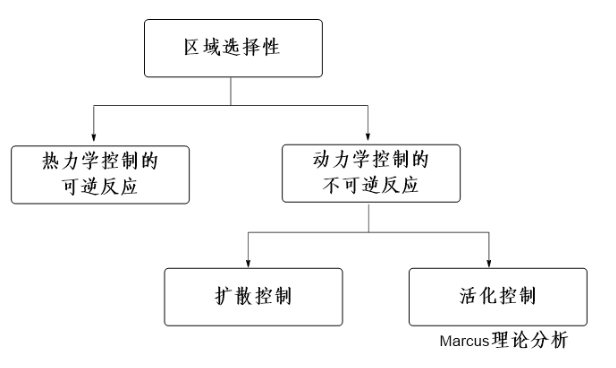
受到Mayr的启发,我们发现通过考察DMC的LUMO特性以及各种亲核试剂的pKa值就足以理解DMC这一试剂的反应特性,避开了HSAB理论带来的困惑之处[4]。
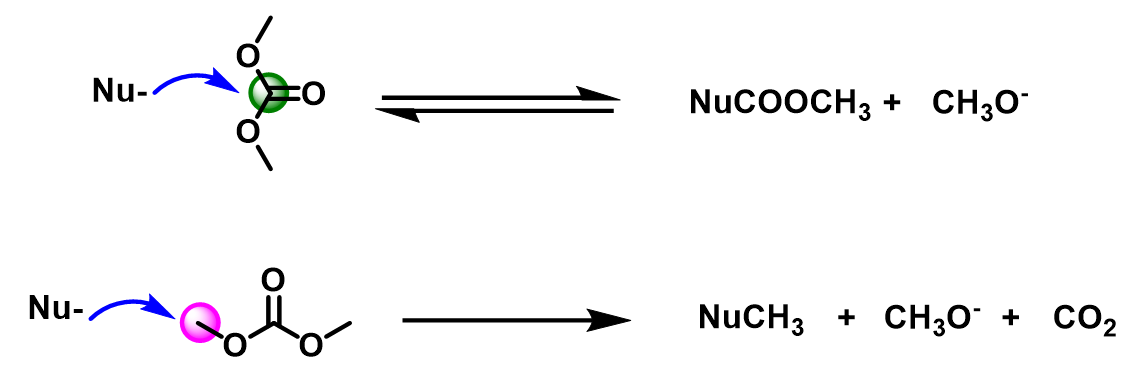
作为一种两可亲电试剂,DMC可以和不同的亲核试剂反应,得到酰基化或烷基化的产物。当DMC的羰基碳受到亲核试剂的进攻时,酰基—氧键断裂,形成酰基化产物,伴随CH3O-的生成;当DMC的甲基碳受到亲核试剂的进攻时,甲基—氧键断裂,形成甲基化产物,伴随CH3O- 和CO2的生成。下面,我们会通过酚,醇,苯胺类亲核试剂作进一步阐述。
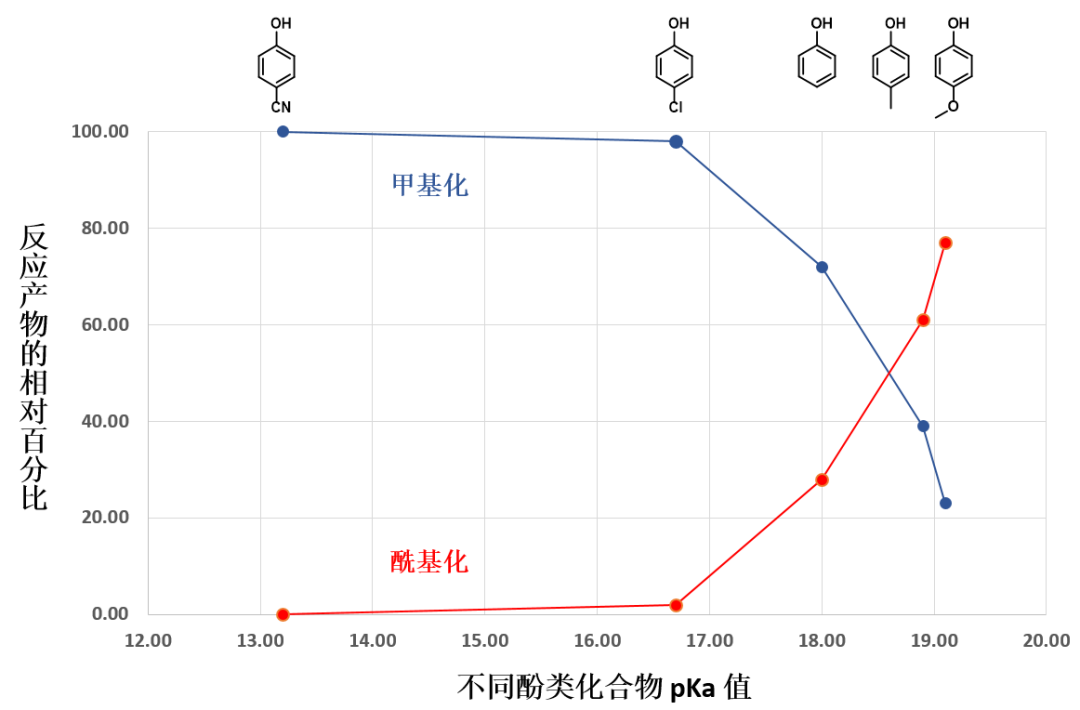
从表1可以看到,不同取代基的苯酚化合物与DMC反应会有不同的主产物生成。原料为对甲氧基苯酚时,以酰基化产物为主;原料为对氰基苯酚时,基本只观察到烷基化产物。

从第一章亲核反应中LUMO计算的应用知道,不论是作为甲基化试剂还是酰基化试剂,首先要考察该试剂的LUMO及LUMO Map[5]:
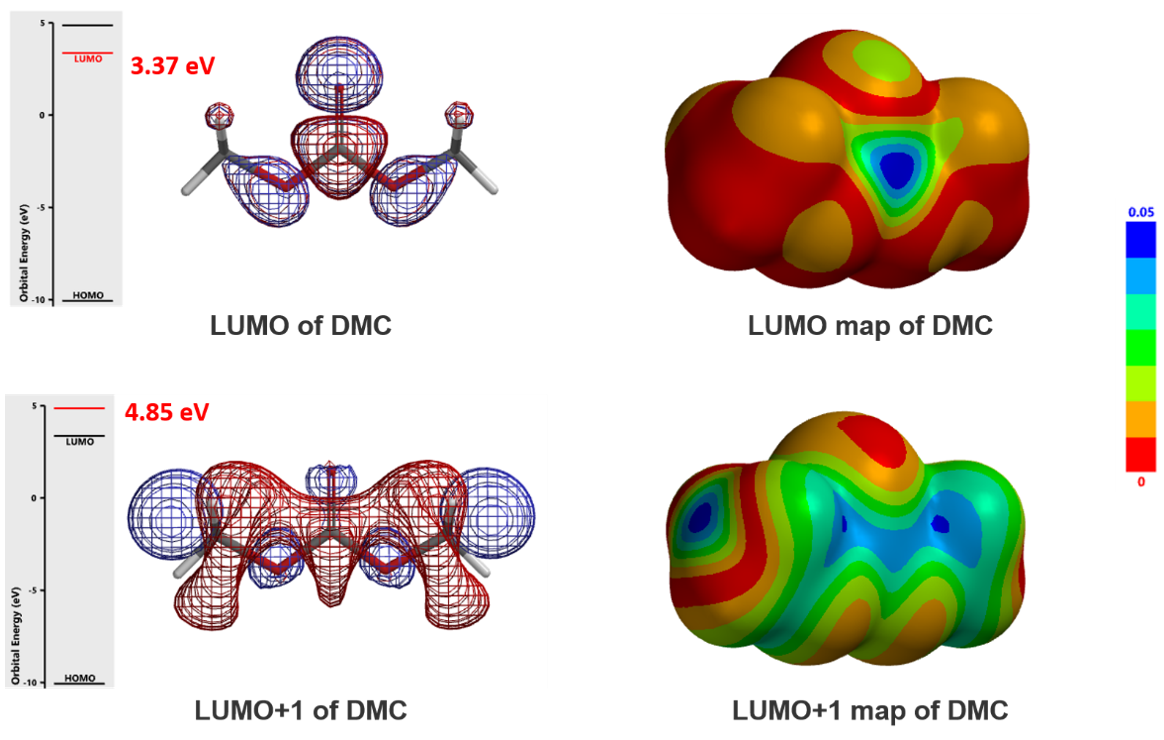
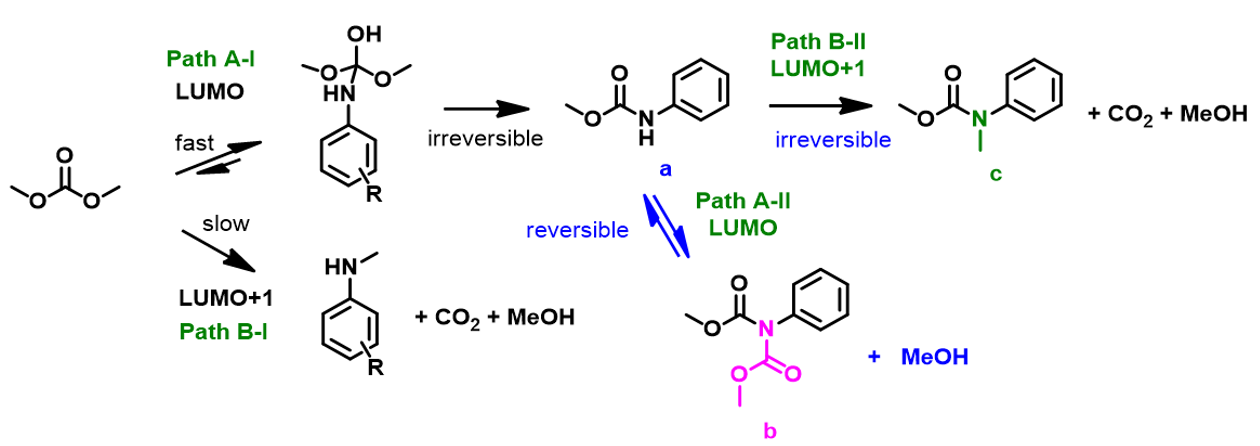
从图3可知,DMC的LUMO(3.37 eV)显示反应位点在羰基C上,而LUMO+1(4.85 eV)显示反应位点在甲基C上。这说明酚会优先与DMC经path A生成O-碳酸酯(图4)后进一步转化为O-酰基化产物。同时也存在经path B与DMC作用生成O-甲基醚的可能性。两种产物的最终比例与反应温度、反应时间,尤其与酚本身的pKa、和反应的可逆和不可逆性有关(图5)。
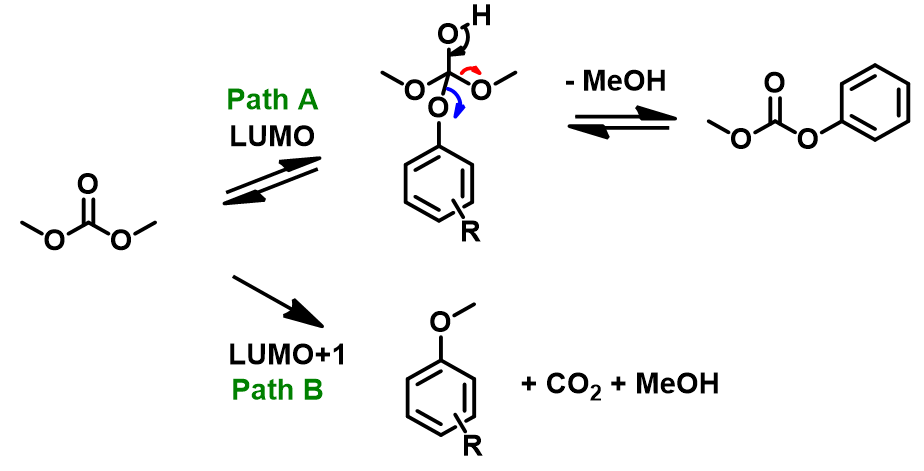
当酚的pKa较高时,如对甲氧基苯酚,它的酸性较弱,优先经path A生成相对稳定的碳酸酯,因此酰基化产物比例就相对高;反之,对于pKa较低的对氰基苯酚,其酸性更强,即便优先生成了碳酸酯,由于产物不稳定会发生可逆的解离,反应平衡会向path B的不可逆甲基化倾斜,最终得到单一的甲基化产物(图4, 5)。
接下来,我们看硫酚、硫醇以及醇类化合物与DMC的反应。以表2为例:
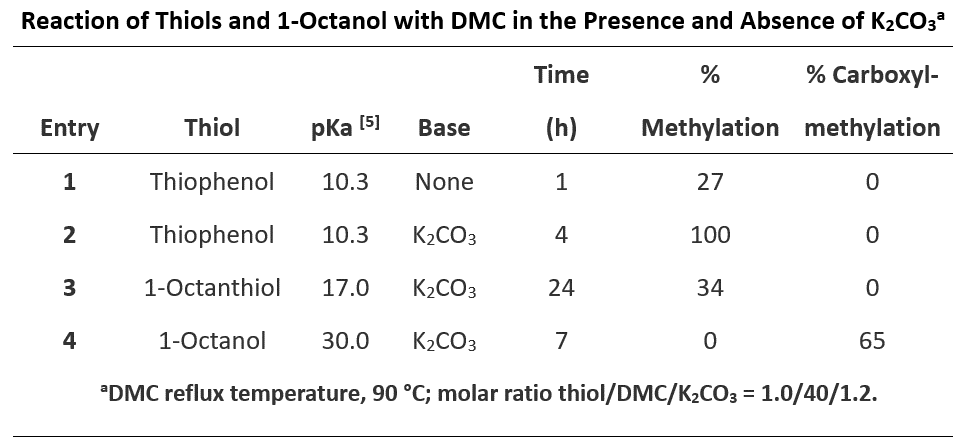
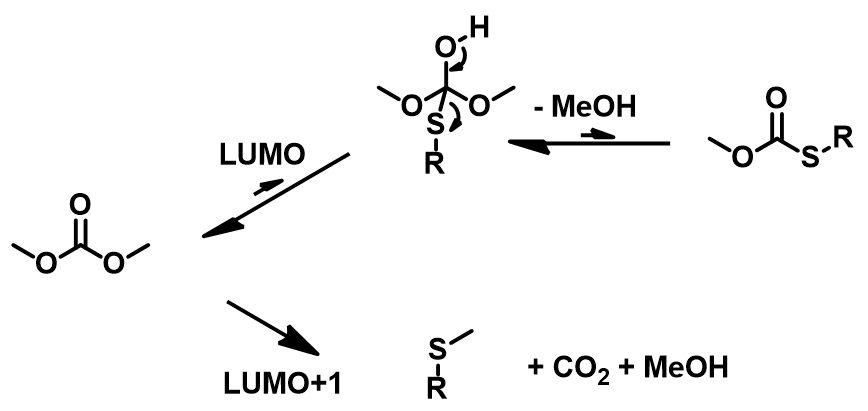
硫的亲核能力比氧强,在没有碱存在的情况下就可以发生反应。硫酚的pKa远小于对应的醇,在硫酚、硫醇和DMC羰基加成的四面体中间体中,硫酚是比甲醇更好的离去基团,相对于生成硫酯,其逆反应生成碳酸二甲酯更容易进行。同时S-碳酸酯比DMC的反应性更强,S-酰基化的产物很难生成(图6)。而1-octanol作为脂肪醇,pKa为30.0,在碳酸钾碱性条件下,不能发生去质子化,此时醇类化合物只能和DMC相互作用得到酯交换的产物,由热力学控制。
最后,我们再来看苯胺类化合物与DMC的反应。以苯胺(表3)为例:
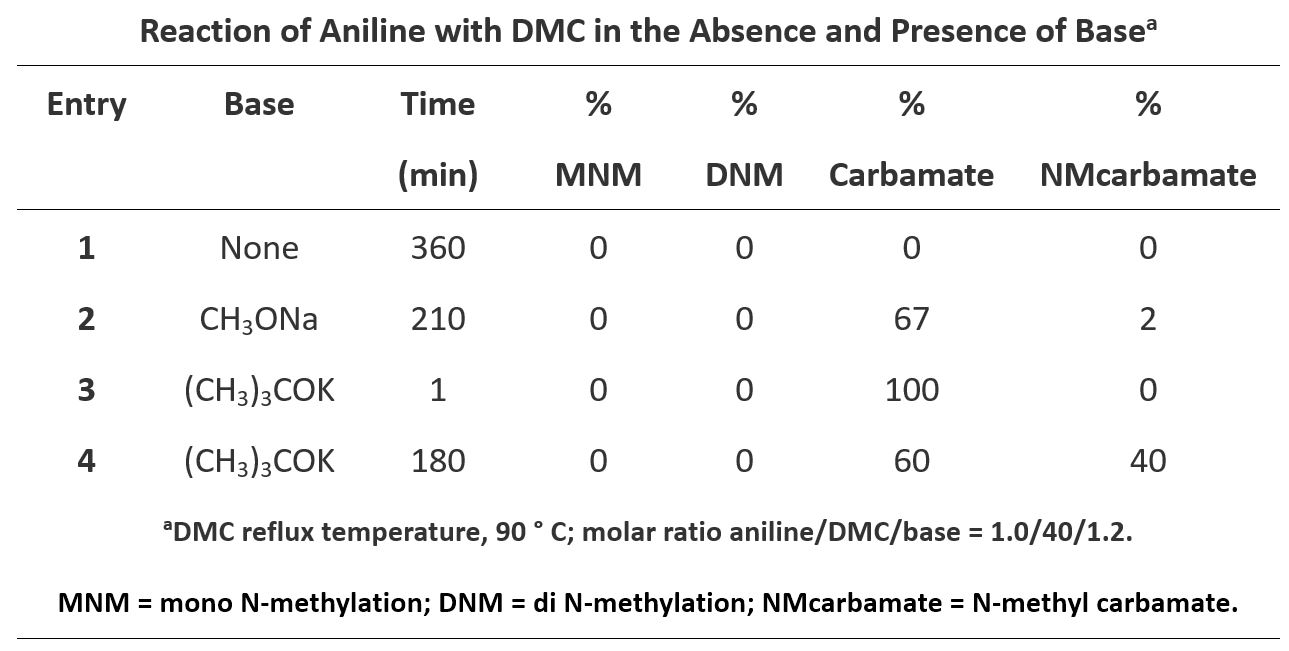
苯胺和DMC的反应与酚、硫酚、硫醚与DMC的反应表现出不同的结果。在没有碱存在的条件下,苯胺与DMC不发生反应。CH3ONa作碱时,苯胺可与DMC的羰基碳快速反应,生成相对稳定的氨基甲酸酯,为不可逆反应(图7,Path A-I)。虽然苯胺与DMC的甲基化作用产物也能够稳定存在,但甲基化所需的能量(LUMO+1) 更高 (Path B-I) ,故酰基化更占优。单酰基化的产物a可以继续和DMC经Path A-II生成双酰基化的产物b,但是由于该产物的稳定性差,极易降解回a,不容易分离得到终产物。同样a也可经Path B-II进一步烷基化得到c,由于相对苯胺,化合物a带有酰基吸电子基团,a的酰胺NH的pKa比苯胺的pKa小,更易发生反应。随着碱的增强,以及反应时间的延长,烷基化的酰基化产物c会慢慢的累积,直至反应结束。
以上就是这章要讲的内容啦!从LUMO, pKa, 可逆和不可逆的视角来探讨碳酸二甲酯两可反应特性达到更深入的理解,从而能够更精确的在有机合成路线设计中预判。如果您对亲核试剂离去特性感兴趣,可以阅读“QM魔法小课堂”第三章和第十二章的相关知识。
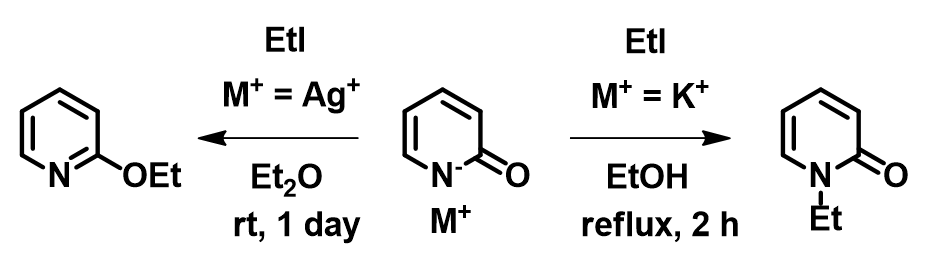
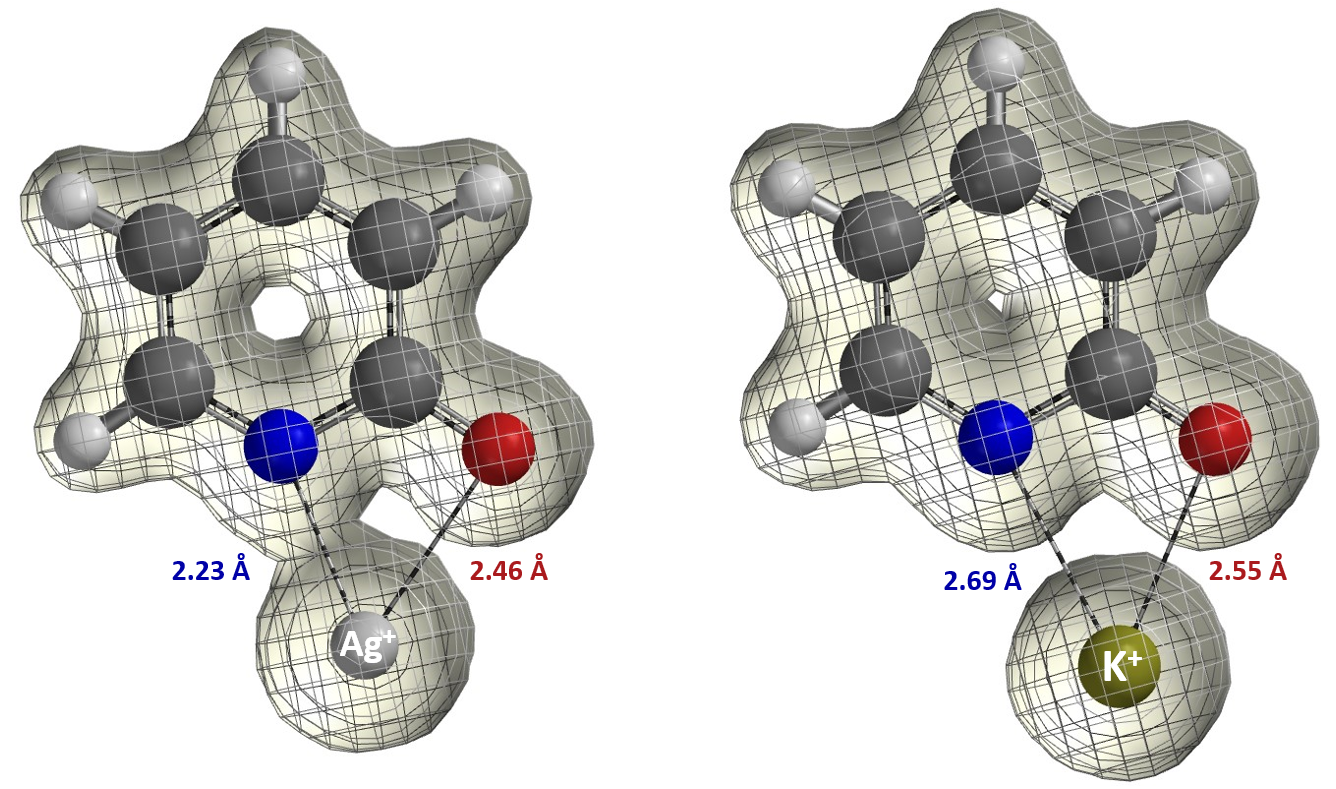
现在让我们思考吡啶酮乙基化反应的结果(图8)。2010年,Mayr指出,在银盐条件下,吡啶酮乙基化反应结果不能用SN1碳正离子机理来解释[7]。大家可以尝试从下面QM计算出来的电子密度图[8]提出一个合理的解释。我们也鼓励各位读者阅读Mayr的优秀评论文章[3],“和HSAB概念告别”、使用热力学及动力学分析各种两可反应。
温馨小提示:
下一章,我们会奉上圣诞大礼:对无量子效应的有机反应做一个全面的概述。敬请期待!
参考文献:
[1] Pearson, R.G. J. Am. Chem. Soc. 1963, 3533.
[2] Tundo, P., Rossi, L., Loris, A. J. Org. Chem. 2005, 70, 2219.
[3] Mayr, H., Breugst, M., Ofial A. R. Angew. Chem. Int. Ed. Engl. 2011, 6470.
"Farewell to the HSAB Treatment of Ambident Reactivity: We have analyzed literature reports on the regio-selectivities of these and other ambident nucleophiles and electrophiles, and we have realized that the number of cases where the HSAB principle and the concept of charge- and orbital-controlled reactions give correct predictions approximate the number of cases where they fail. For that reason, we suggest abandoning these concepts as guides for predicting ambident reactivity.”
[4] Drago, R.S. J. Chem. Educ. 1974, 51, 300-307 and references 6 – 9 cited in Mayr, H., Breugst, M., Ofial, A. R. Angew. Chem. Int. Ed. Engl. 2010, 6470.
[5] Warren J. Hehre (2003). A Guide to Molecular Mechanics and Quantum Chemical Calculations. Irvine, CA, USA: Wavefunction, Inc.
b. https://organicchemistrydata.org/hansreich/resources/pka/#kaalcohol
c. https://organicchemistrydata.org/hansreich/resources/pka/#kathiol
[7] Breugst, M., Mayr, H. J. Am. Chem. Soc. 2010, 15380.
[8] Johnson, E. R., Keinan, S., Mori-Sánchez, P., Contreras-García, J., Aron, J., Cohen, A. J., Yang, W. J. Am. Chem. Soc. 2010, 6498.
本文由王守亮、王健、石谷沁、王秋月、郑重、卫小文编撰。