网站维护
系统内容更新/升级中

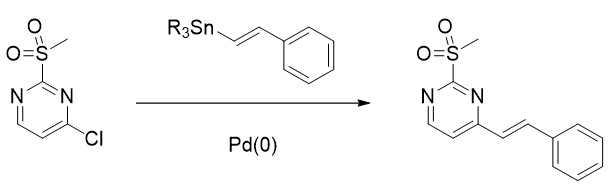
关于多卤素嘧啶在不同类型反应中的区域选择性,我们已经在第1章、第7章、第29章介绍过了。本章则是为大家解惑2-甲磺酰基-4-氯嘧啶在反应过程中的区域选择性问题。如图1所示,类似于2,4-二氯嘧啶的取代反应,2-甲磺酰基-4-氯嘧啶与胺的芳香亲核取代也发生在4位,但是与氧负离子的芳香亲核取代反应会选择性地发生在2位;与锡试剂做Stille偶联反应时,4位发生反应;若是将芳香胺转化为芳香甲酰胺后再做取代反应则发生在2位。
2-甲磺酰基-4-氯嘧啶在这些反应中表现出如此大的区域选择性差异,是什么原因引起的呢?
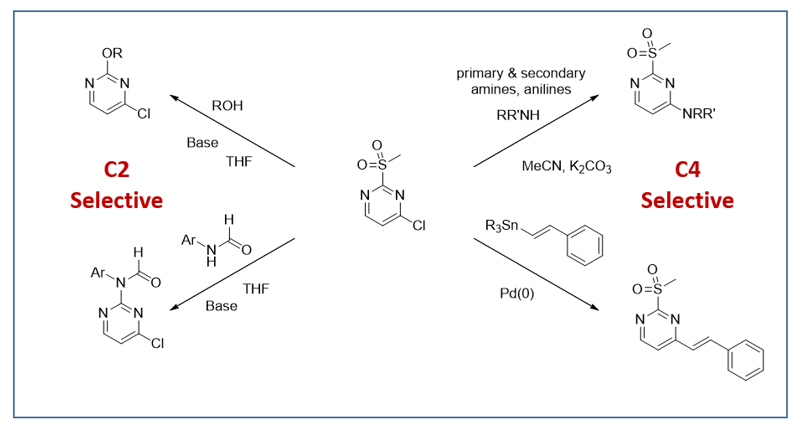
经检索发现,已有多篇文献报道了2-甲磺酰基-4-氯嘧啶与氧负离子的芳香亲核取代反应仅发生在2位,而且在-78°C反应即可发生[1],但是从1993年第一次报道至今,我们没有检索到相关报道对这样的实验现象做出合理解释,其原因一直困扰着我们[2]。这一章将用QM推测它的反应历程,并尝试对其做出合理的解释。首先对2-甲磺酰基-4-氯嘧啶进行分析,如图2所示,C4位有LUMO分布,C2位有LUMO+1分布且能量相近,仅差0.09 eV,这表明C2和C4都可以发生取代反应。
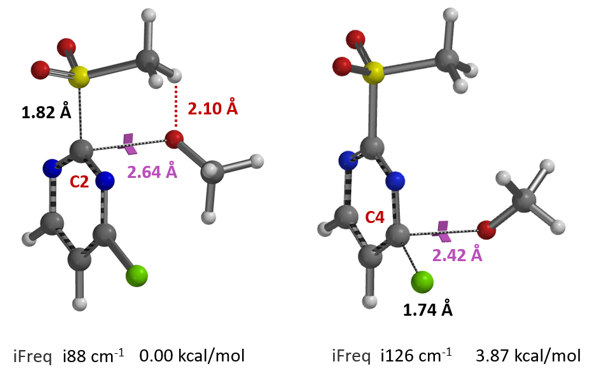
我们假设当氧负离子向2-甲磺酰基-4-氯嘧啶靠近时,氧负离子与甲磺酰基的甲基氢之间有氢键作用。第一步是计算这个氢键复合物的Equilibrium Geometry。计算结果显示氧负离子与甲磺酰基的甲基氢之间的距离是1.86 Å(图3,左),通过电子密度图(图3,中和右)可以观察到非常强的氢键作用,这可能是引导C2位发生SNAr反应的关键因素。
文献报道了2-甲磺酰基-4-氯嘧啶与芳香甲酰胺的亲核取代反应也是发生在C2位[4, 5],那么它的反应机理又是怎样的呢?我们以2-甲磺酰基-4-氯嘧啶与甲基吡唑甲酰胺的反应(图6)为例,首先结合2-甲磺酰基-4-氯嘧啶与芳香甲酰胺阴离子的Equilibrium Geometry来计算它们的反应能量分布,并建立甲酰胺阴离子进攻步骤的起始模型(图7),可以看到起始的过渡态不仅在甲磺酰基的H 和甲酰胺 N有一个2.24 Å的氢键的作用力,还存在分子间的pi-pi作用力。
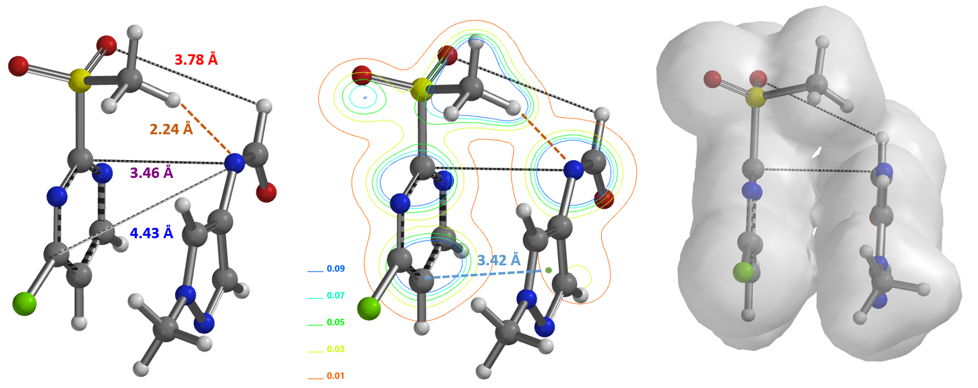
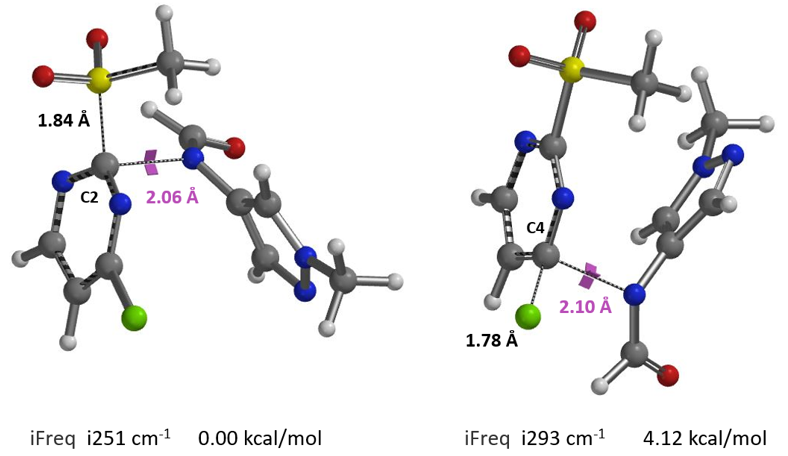
模拟甲酰胺阴离子进攻C2原子的过程,计算得到C2取代反应过程的能量变化曲线(见图8左侧),活化能约为8.75 kcal/mol,反应温度需在室温到50°C进行,整个过程氢键依然是保留的。再模拟进攻C4原子的反应过程,计算得到其能量变化曲线(见图8右侧),活化能约为14.71 kcal/mol,需要断开氢键作用力,跨越能垒相比进攻C2位要高,因此反应高选择性的发生在C2。
我们分别计算两个过渡态的虚频以及相对能量(图9)。C4位发生取代的过渡态能量比C2位高4.12 kcal/mol,从C2位取代的过渡态结构的切片等值线图(图10)中可以看到,除了文献中提到的亲核试剂需要阴离子化来提高C2位的区域选择性的原因以外还有两个重要的原因:1)-SO2CH3 H对甲酰胺 N 的氢键(2.58 Å)诱导甲酰胺离子进攻C2原子。2)氢键会在甲酰胺的氢和MeSO2-氧之间形成(2.53 Å),进一步稳定了过渡态,降低了活化能,这就解释了为什么只有甲酰胺可以提高分离收率和选择性。甲酰基氢原子在这个高选择性的反应中起着关键作用。
通过上面的两个QM的例子,我们可以给出以下结论:
在C2位的取代反应的原因有:1. 阴离子化的亲核试剂与甲磺酰基的质子存在氢键作用;2. 氢键可以稳定反应过渡态;3. 甲磺酰基会引导阴离子化的亲核试剂去进攻C2位原子从而实现了C2位的芳香取代反应。
2-甲磺酰基-4-氯嘧啶在进行芳香亲核取代反应时甲磺酰基具有诱导效应,与阴离子化的亲核试剂产生的氢键相互作用,可以稳定其过渡态并可能阻断潜在的反应途径。当反应涉及氢键、非共价相互作用(Non-Covalent Interaction, NCI)[8],空间相互作用和电子相互作用等时(见第9, 23, 26, 33, 42章),它们的反应结果可能会变得很复杂,我们往往无法直观的预测。QM是一个学习有机化学的强大工具,一个客观分析方法。基于实验的条件和现象来学习建立及不断改进计算反应模型,我们就可以加深对反应的理解。如果你们遇到了其他有趣的化学,请告知我们,大家一起解析学习。
2-甲磺酰基-4-氯嘧啶与仲胺反应仅发生4位取代,这又要如何分析呢?
仲胺的N上有孤独电子和N-H,与甲磺酰基氧之间有很多潜在的相互作用。计算表明2-甲磺酰基-4-氯嘧啶与仲胺形成复合物(见图14),形成该复合物的ΔE为-6.81 kcal/mol。从电子密度切片等值线图可以看到:
1.仲胺上的NH与甲磺酰基上的一个O之间的氢键键长为2.42 Å。
2.仲胺N上的孤对电子与嘧啶上缺电子的C2之间具有更高的电子密度,形成的NCI,相距3.00 Å。
3.仲胺的氢与嘧啶N1和N3的自然电荷(蓝色标记)之间的存在三种潜在静电荷相互作用。
你将如何进一步分析这个问题?
本文由陆颖、刘文锋、王秋月、卫小文编撰。
参考文献:
[1] C. M. Serrano, R. E. Looper,Org. Lett. 2011, 13, 5000; A. S. Carlson, H. R. Cui, A. Divakaran, J. A. Johnson, R. M. Brunner, W. C. K. Pomerantz, J. J. Topczewski, ACS Med. Chem. Lett. 2019, 10, 1296.
[2] M. L. Falck-Pedersen, B. Tore, U. Kjell,Acta Chem. Scand. 1993, 47, 72.
[3] F. M. Bickelhaupt, K. N. Houk, Angew. Chem. Int. Ed. 2017, 56, 10070. Small HOMO and LUMO energy gap and little structure distortion from reactant to transition state led to low activation energy.
[4] C. M. Li, F. Haeffner, S. J. Wang, C. C. Yuan, D. Shang, X. L. Shi, B. Ma, B. T. Hopkins, E. M. O’Brien, Org. Process Res. Dev. 2022,26,137.
[5] B. Barlaam, R. Ducray, C. Lambert-van der Brempt, P. Plé, C. Bardelle, N. Brooks, T. Coleman, D. Cross, J. G. Kettle, J. Read, Bioorg. Med. Chem. Lett. 2011, 21, 2207.
[6] P. Chatelain, A. Sau, C. N. Rowley, J. Moran, Angew. Chem. Int. Ed. 2019, 58, 14959.
[7] B. L. Mylari, P. J. Oates, W. J. Zembrowski, D. A. Beebe, E. L. Conn, J. B. Coutcher, M. T. O'Gorman, M. C. Linhares, G. J. Withbroe, J. Med. Chem. 2002, 45, 4398.
[8] QM有机化学课堂第42章