网站维护
系统内容更新/升级中

氢键(Hydrogen Bond)是一种广泛存在于分子内或分子间的相互作用。从日常生活中的冰块到DNA双螺旋结构,从分子的最稳定构象到蛋白与配体的相互作用,氢键在生物结构功能、药物的设计和新材料等领域有着重要的作用[1]。
一般氢键可表示为“X-H······Y-Z”,其中“······”代表氢键,是与电负性原子X相连的氢作为氢键给体,和富电子区域的氢键受体Y之间的静电相互作用。最常用判断氢键的方法是键长,氢键越短,强度越强。但是随着人们对氢键的认识不断加深,氢键的种类也不断增加,比如氢键受体Y不仅仅限于孤对电子,也可以是阴离子,或者π电子[2],这些都让氢键的判断更加复杂[3]。
在量子化学中,电子密度是电子存在于给定点周围单位空间中概率的量度。曲面连接相等值的点,即得到等值面,它可以显示为点的排列、网格或不透明或半透明的实体。通过原子之间的电子密度变化就可以显示原子之间的电子分布情况和“键”的强弱[4,5]。
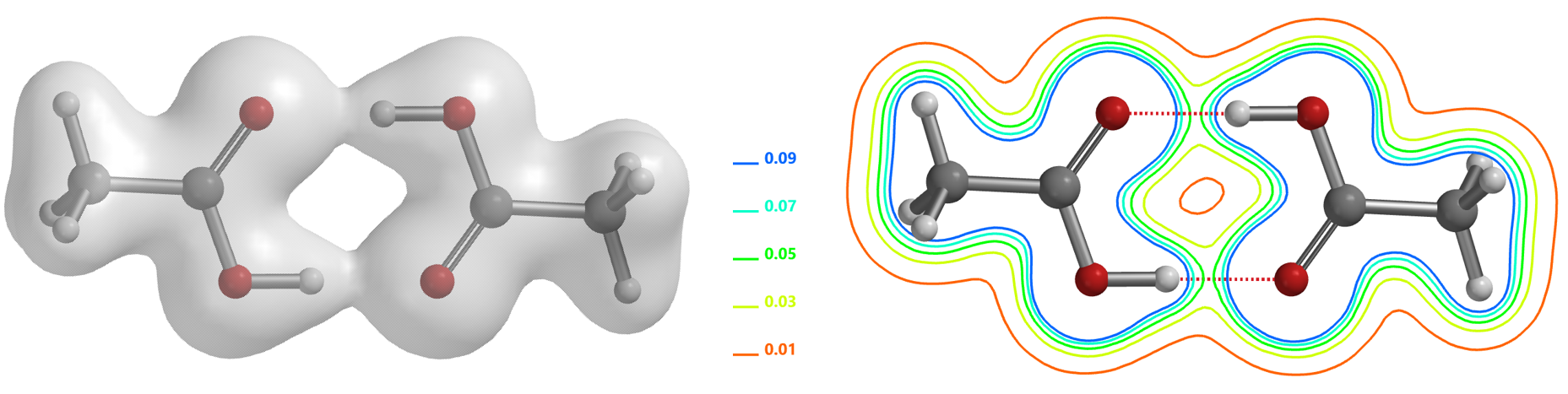
近年来,科学家们发现氢键和共价键之间并没有明显界线,短强氢键的本质可以描述为一个共价键[6]。因此,利用电子密度图同样可以观察氢键相互作用。如图1中的醋酸二聚体的电子密度表面可以看到两个氢键的O和H之间共享部分电子,氢键之间存在电子密度的三维空间临界点[2],在氢键的方向上存在最小值,在远离氢键的方向有最大值,在形式上体现为电子密度表面像一座桥一样连接起来,在切片等值线图上表现为4条等值线的顶点指向该临界点。
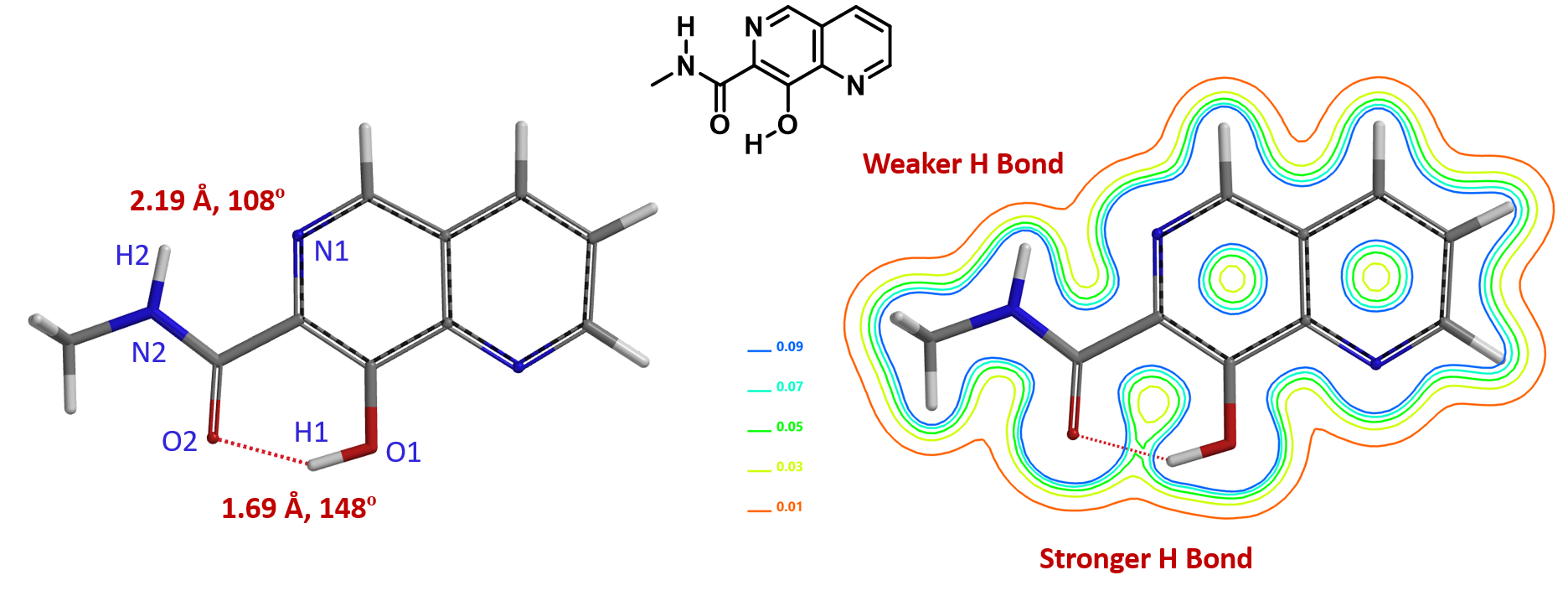
对于分子中有多个氢键的分子,利用电子密度图就可以非常方便的“看到”氢键的强弱。如图2中的8-羟基-N-甲基-1,6-萘啶-7-甲酰胺,O2-H1距离1.69 Å,O2-H1-O1键角为148°,符合软件显示“氢键”的狭义标准:N或O相连的氢与另一个O或者N的距离在1.6 Å到2.1 Å之间,X-H......Y键角>120°[4]。从电子密度切片等值线图,可以看到O2-H1之间有电子密度的临界点,处于0.05等值线和0.07的等值线之间,存在强的氢键。N1-H2距离2.19 Å,N1-H2-N2键角为108°,虽然不符合软件显示“氢键”的狭义标准,但是N1-H2有电子密度的临界点,处于0.01等值线和0.03的等值线之间,揭示另一个分子内键,一个较弱的氢键。
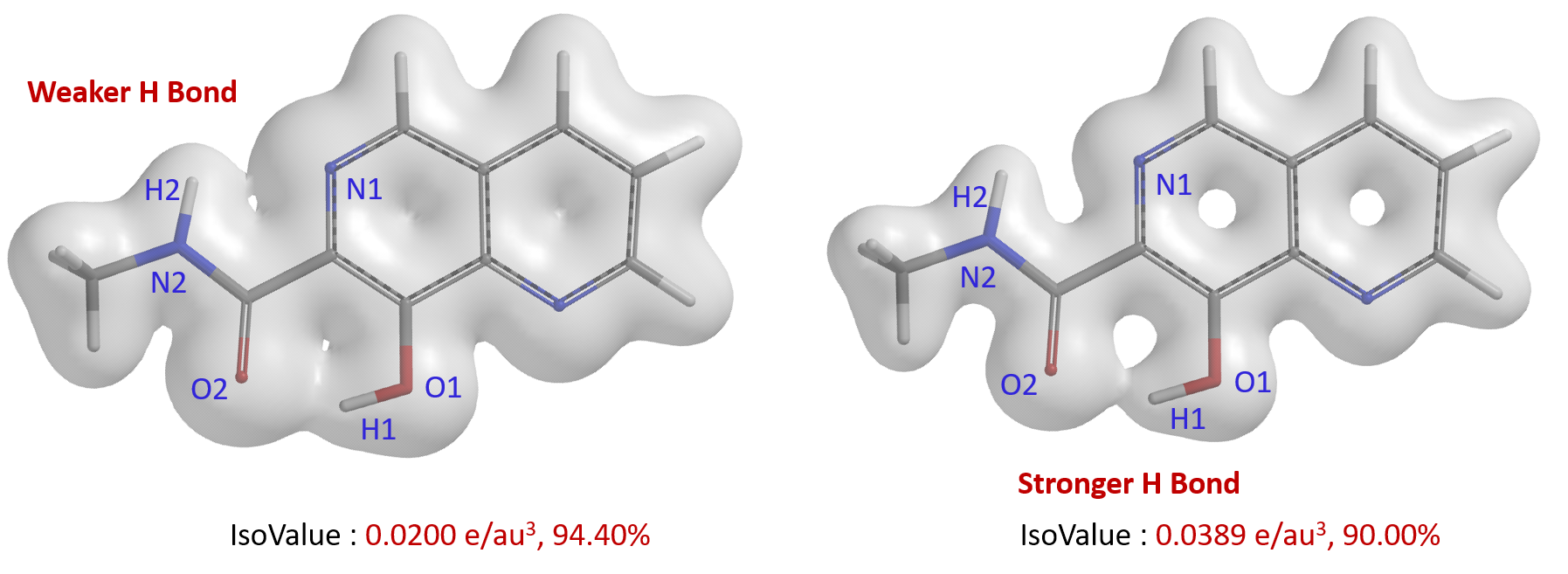
N1-H2之间的弱氢键相互作用利用电子密度表面的半透明图能够更加直观的观察到(图3)。设定IsoValue为0.0200 e/au3,可以明显看到O2-H1和N1-H2之间存在电子密度表面的桥连,O2-H1之间临界点的电子密度数值更大,O2-H1之间的“桥”比N1-H2明显更加坚固,氢键强度更强。将IsoValue设定为更大的数值0.0389 e/au3,O2-H1之间还有桥连,N1-H2之间的电子密度表面则断开,可以更明显看出O2-H1之间有更强氢键强度[5]。
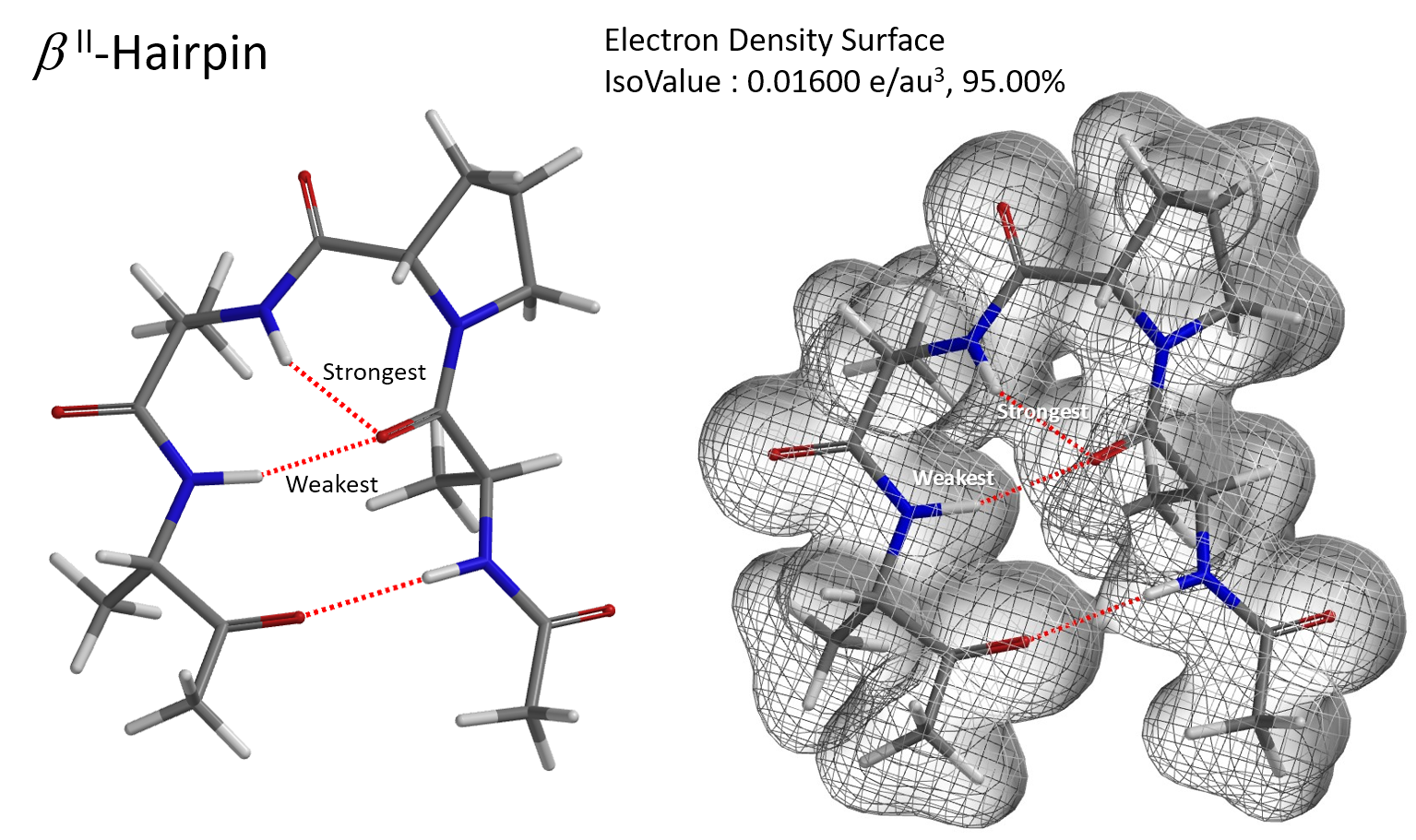
氢键对于生物大分子具有非常重要的意义,它是决定蛋白质和核酸的二、三和四级结构的重要因素,利用电子密度图就可以使复杂结构中的氢键相互作用可视化。图4为蛋白质立体结构中的一种最简单的模体—β发夹折叠[7]。 4个氨基酸的多肽链通过氢键作用形成像发夹一样的构型。图4中的构型存在多个氢键,且不在同一平面,通过切片图无法将多个氢键放在同一个平面进行比较,此时,使用电子密度面网格图可以方便的判断氢键的强弱。
羟基可以通过稳定反应过渡态,降低反应活化能促进反应[8]。但是,当反应底物被氢键作用稳定,参与反应就要先打破氢键作用力,就会使发生反应需要更高的能垒。
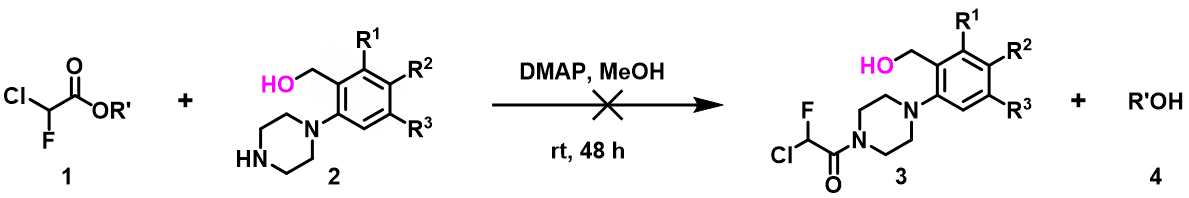
图5所示的胺酯交换反应,底物2没有OH,反应可以顺利发生,但是在多了一个OH后,相同的条件反应完全不发生。通过计算我们发现,甲醇与化合物2中的OH的质子和NH 中的N存在两个氢键相互作用,相比于没有氢键时能量降低了5.59 kcal/mol(图6)。我们推断为了发生想要的亲核进攻, 反应需要首先打破这两个氢键,导致活化能增加,因此反应不发生。由于甲醇对于酰化是必不可少的,羟甲基使用硅烷基保护就能够避免形成上述的络合物,并顺利将哌啶酰化。
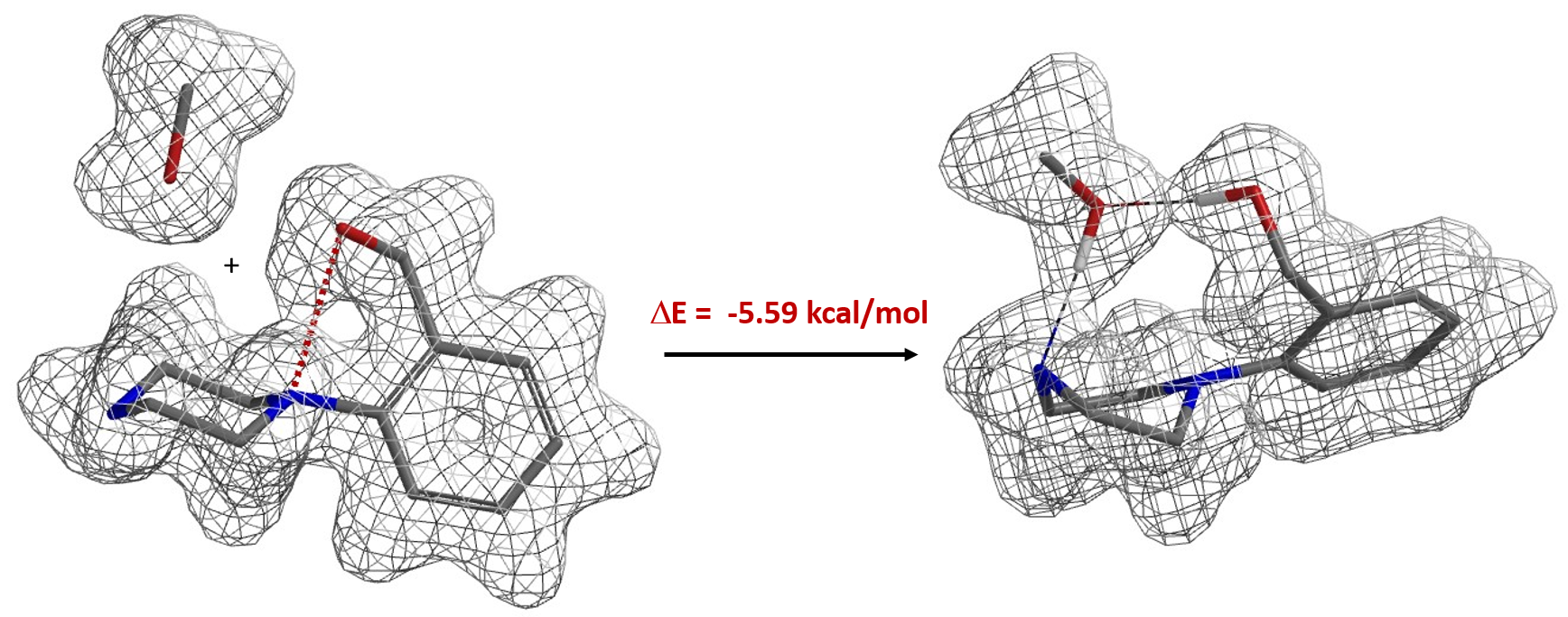
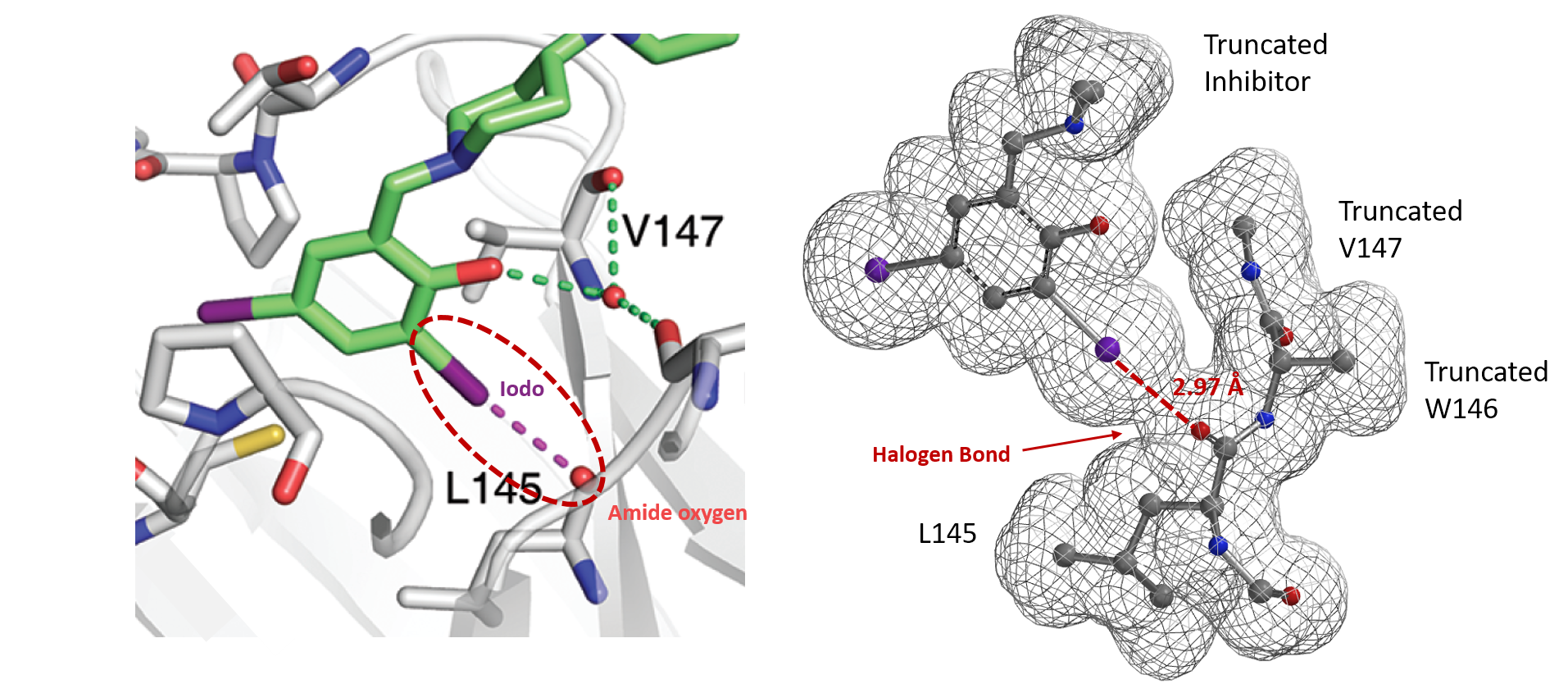
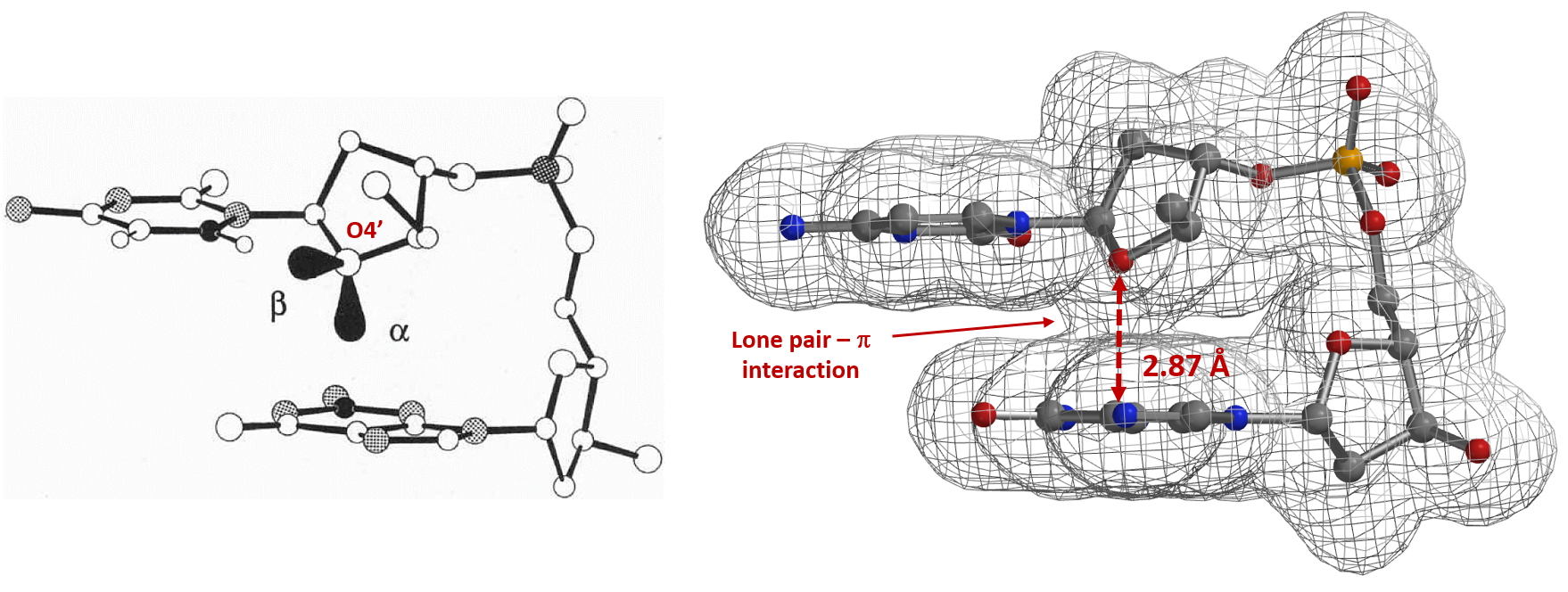
与之相类似,电子密度图同样能够让我们看到和比较其他的非共价键相互作用[9],例如在抑制剂设计的卤键(图7)[10]和生物体系中孤对电子-π 相互作用(图8)[11]等。
总结一下,通过电子密度图可以让我们方便比较同一个分子中的氢键强度。氢键之间的电子密度表面像一座桥一样连接起来,在氢键的方向上存在电子密度的临界值,临界值越大,连接氢键的“桥”越坚固,氢键就越强。当存在多个氢键不在同一个平面时,使用电子密度表面网格图可以更好的帮助我们判断氢键的强弱。同样该方法也可以应用到其他非共价相互作用。通过电子密度图可以从三维空间实现非共价键的可视化,从而为设计新药物、新材料或新配体等提供更加丰富的视角。
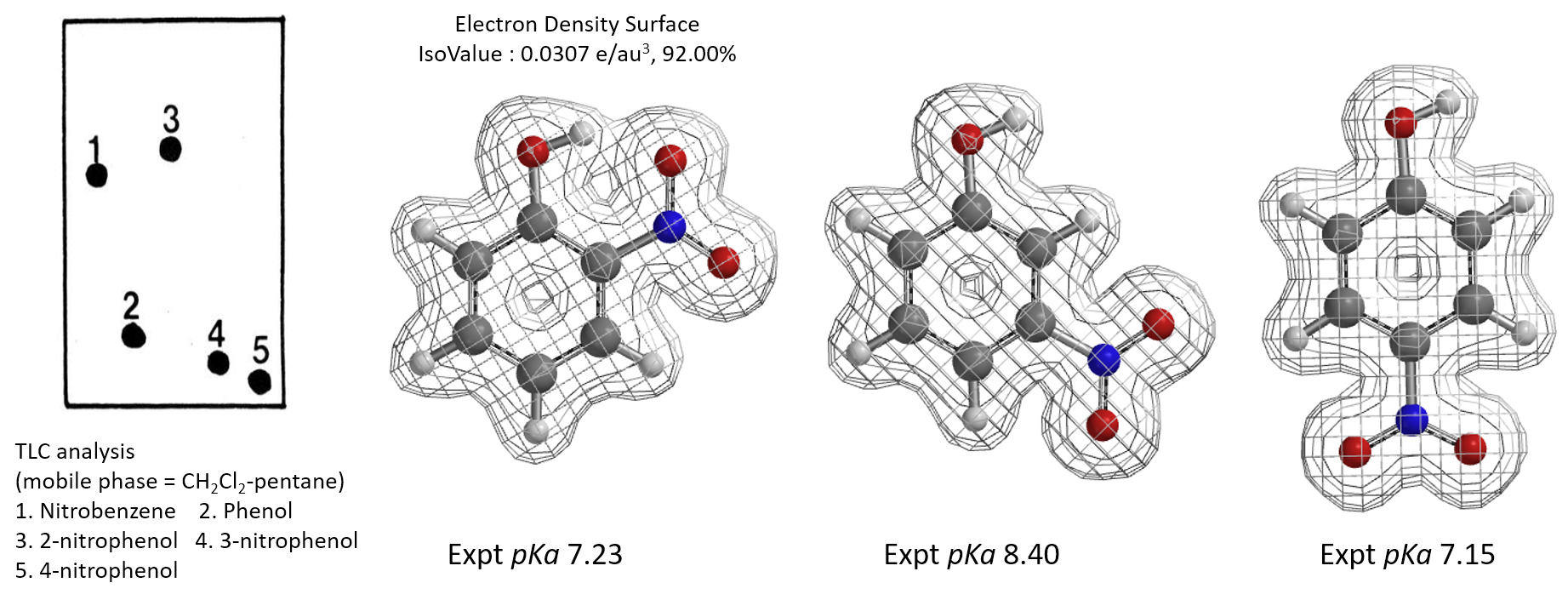
A. Feigenbaum发现在TLC硅胶板上,邻硝基苯酚的极性远小于对硝基苯酚和间硝基苯酚,在DCM-pentane流动相中,极性甚至小于硝基苯[12]。对硝基苯酚和间硝基苯酚极性与苯酚接近。这是为什么呢?是酸性不同导致极性的差别,还是氢键在发挥作用?根据三个分子的pKa和电子密度表面图你可以分析真正的原因吗?
本文由潘东、黄欣、刘文锋、赖光华、卫小文编撰。
参考文献:
[1] L.J. Karas, C.H. Wu, R. Das, J.I.C. Wu, WIREs Comput. Mol. Sci., 2020, 10, 1477.
[2] Definition of the hydrogen bond (IUPAC Recommendations 2011): E. Arunan, G. Desiraju, R. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. Clary, R. Crabtree, J. Dannenberg, P. Hobza, H. Kjaergaard, A. Legon, B. Mennucci, D. Nesbitt, Pure Appl. Chem., 2011, 83, 1637.
[3] QM有机化学课堂第23章:QM探索TBABr3反应的对位选择性机理。
[4] Spartan’20 Tutorial and User’s Guide. Irvine, CA, USA: Wavefunction, Inc. 2021; p 256, 362, 368.
[5]https://en.wikipedia.org/wiki/Electron_density
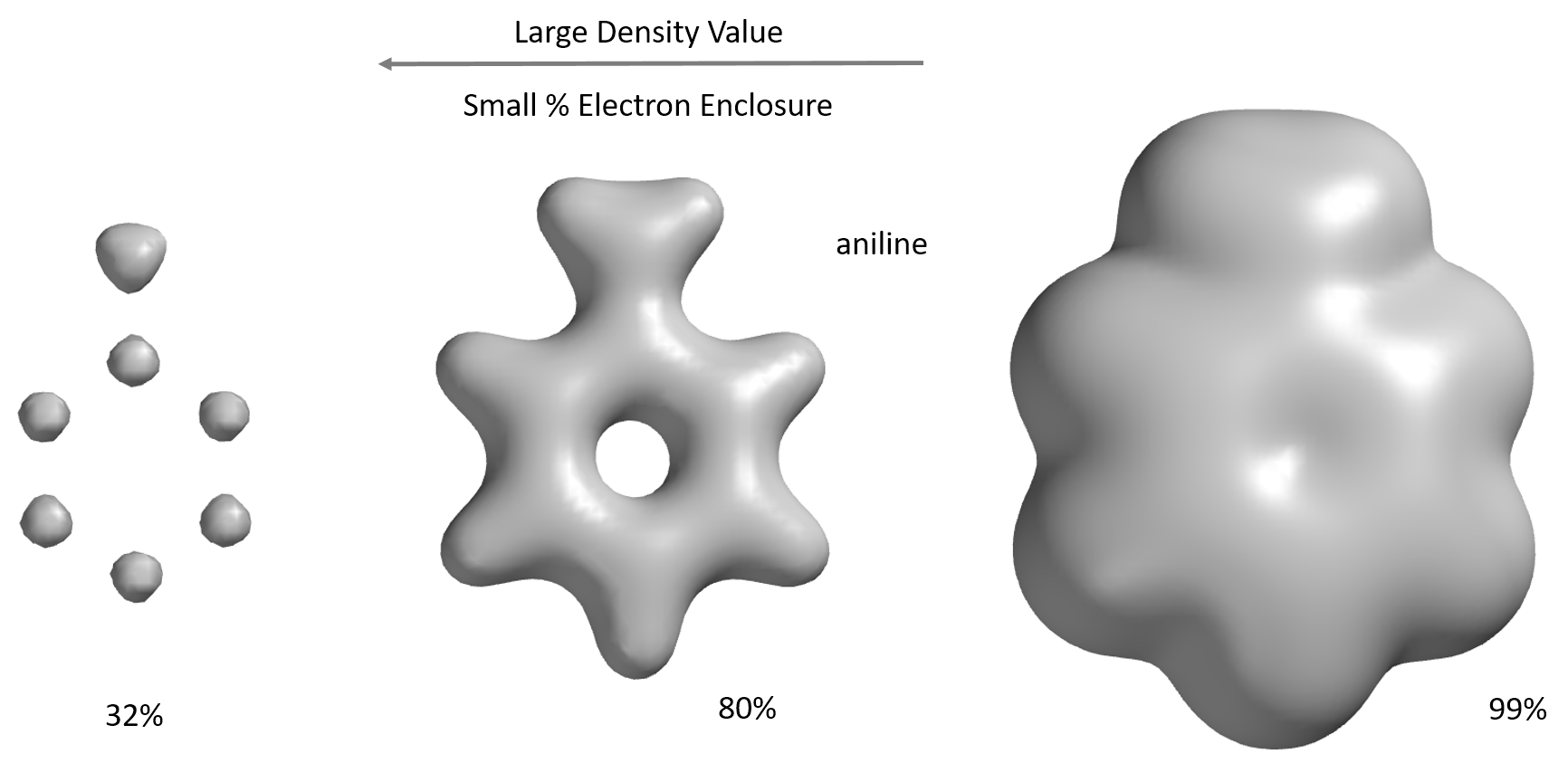
包含分子大部分(> 99%)电子的电子密度表面形成的空间填充模型,即范德华表面。包含约80%电子的电子密度表面揭示了原子之间的连接(“键”)。最高的电子密度分布在原子周围。不同的电子密度表面可以反映分子的不同体积和形状。
[6] B. Dereka, Q. Yu, N.H.C. Lewis, W.B. Carpenter, J.M. Bowman, A. Tokmakoff, Science, 2021, 371, 160.
[7] R.W. Hoffmann, Angew. Chem. Int. Ed.,2000, 39, 2054.
[8] QM有机化学课堂第15、23、26和33章中展示了氢键作用影响活化能的案例。
[9] E.R. Johnson, S. Keinan, P. Mori-Sanchez, J. Contreras-Garcia, A.J. Cohen, W.T. Yang, J. Am. Chem. Soc., 2010, 132, 6498. Non-covalent interactions have a unique signature and their presence can be revealed solely from the electron density. They are highly non-local and manifest in real space as low-gradient isosurfaces with low densities.
[10] G. Cavallo, P. Metrangolo, R. Milani, T. Pilati, A. Priimagi, G. Resnati, G. Terraneo, Chem. Rev. 2016, 116, 2478.
[11] J. Novotný, S. Bazzi, R. Marek, J. Kozelka, Phys. Chem. Chem. Phys., 2016, 18, 19472.
[12] A. Feigenbaum, J. Chem. Edu., 1986, 63, 815.