网站维护
系统内容更新/升级中

在第十三章和第十四章,我们谈论了立体化学中的二面角与扭转张力的关系以及扭转扫描在药物分子设计中的应用。本章我们来进一步利用QM计算来研究立体化学中的另一个知识点—阻转异构体(atropisomers)。阻转异构体是由于单键旋转受阻而产生的立体异构体,简单点说就是单键旋转受阻而产生的轴手性。如图1所示,单键的两侧存在位阻较大的取代基A、A’、B和B’,这就导致旋转时基团之间存在相互排斥作用。当旋转需要克服的能垒足够大时,一对阻转异构体在室温下不能快速相互转化,就有可能通过手性拆分进行分离。
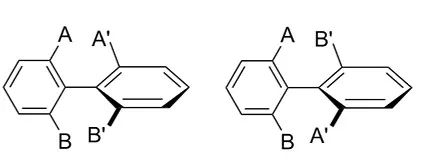
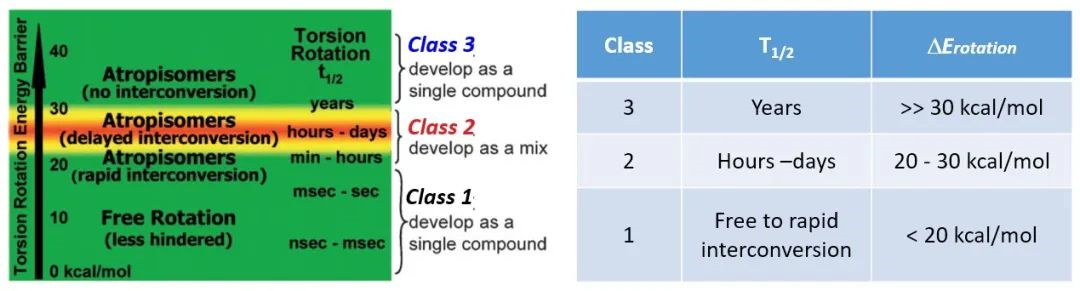
据统计,FDA批准的80%的激酶抑制剂都具有轴手性[2]。根据文献[3,4]报导,轴手性分子在旋转时克服的能垒不同,发生消旋的半衰期(T1/2)也不同,我们可以将其分为3类。
第1类,⊿Erot < 20 kcal/mol,半衰期(T1/2)以秒为单位,可以自由、快速地旋转,显示为单一化合物。
第2类,20 kcal/mol < ⊿Erot < 30 kcal/mol,T1/2在小时和天之间,能发生较快的旋转,能被手性SFC分离,但之后会快速消旋,以混合物状态存在。
第3类,⊿Erot > 30 kcal/mol,T1/2以年为单位,阻转异构体非常稳定,可以进行手性分离,开发单一化合物。
利用QM扭转扫描计算就可以得到发生旋转需要克服能垒的大小,帮助我们判断阻转异构体互变速率,指导我们进行分子设计,判断在纯化具有轴手性药物分子时是否需要进行手性SFC分离,从而缩短实验周期。
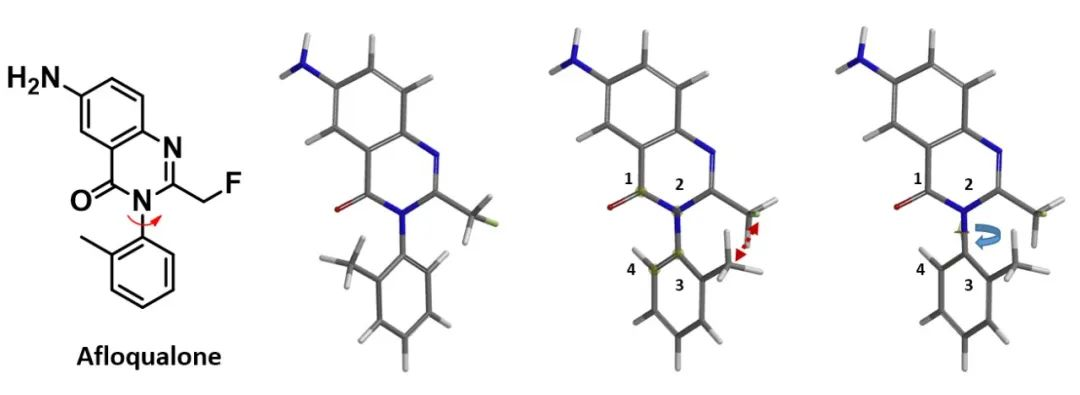
接下来,我们以氟喹酮为例,展示如何利用QM扭转扫描计算低能构象之间的互变能垒。
如图3所示,首先使用MMFF计算得到化合物的低能构象。然后从Geometry菜单中,选择Measure Dihedral,按顺序单击C1-N2-C3-C4原子,选择要旋转的二面角。从二面角为15º开始,以15º为增量,到345º(共23步)进行扭转扫描,使用Hartree-Fock 6-31G**(gas phase)计算能量变化曲线[4]。
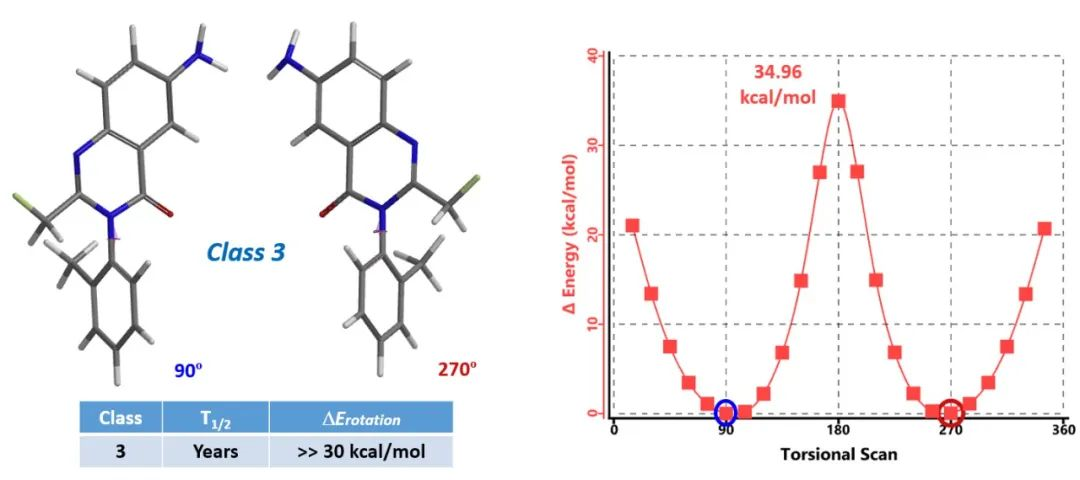
计算结果如下图4所示:当二面角为90º和270º时,对应了两种低能构象,相对能量最低,为0 kcal/mol。而当其旋转到180º时,两个大位阻的取代基共平面,此时能量最高,自由旋转需要克服的能垒为34.96 kcal/mol。因此,我们将氟喹酮划分到第3类,这对阻转异构体可以使用手性SFC分离,并在室温下稳定存在,可以开发为单一手性化合物。
通过计算阻转异构体的互变能垒可以指导我们进行分子设计。提前对设计的分子进行计算,判断是否会属于第二类分子。对于处于第二类的分子可以考虑在分子上增加位阻使其互变能垒增加进而将化合物推至第3类,或者去除某些基团减小位阻使其转化为第1类化合物。当然,还有一种选择,就是通过在环上添加一样的取代基使分子对称,从而完全消除阻转异构现象。
阻转异构体在不同的环境中,其相互转化速率是不同的。据报道HIV-1整合酶抑制剂MK-0536[5]和内皮素A型拮抗剂BMS-207940[6]的阻转异构体在血浆/血清中可以加速相互转化。
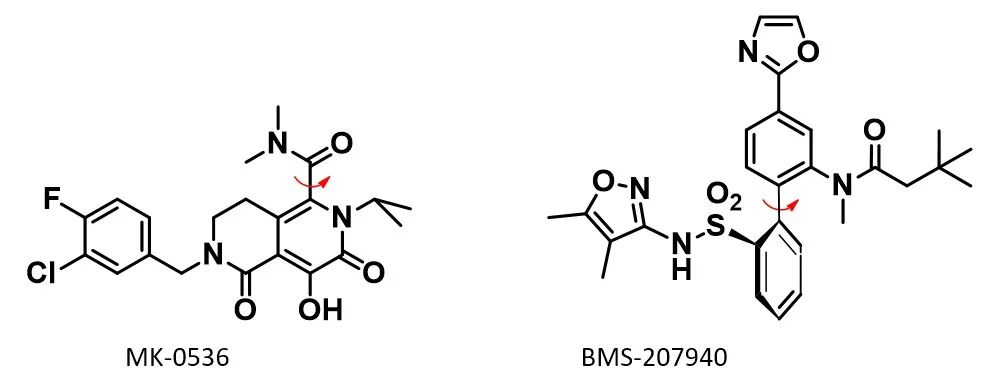
以MK-0536为例 (计算时N-苄基简化为N-甲基),分子的阻转异构来源于分子中的红色箭头标注的C-C键,因此我们计算对该C-C键为轴的二面角进行QM扭转扫描计算,结果如下图6所示。二面角为90º和270º时为其两个最低构象,两个低能构象发生互变需要克服的能垒为27.29 kcal/mol,是属于第2类阻转异构体,在常规条件下的半衰期应该以天计算。
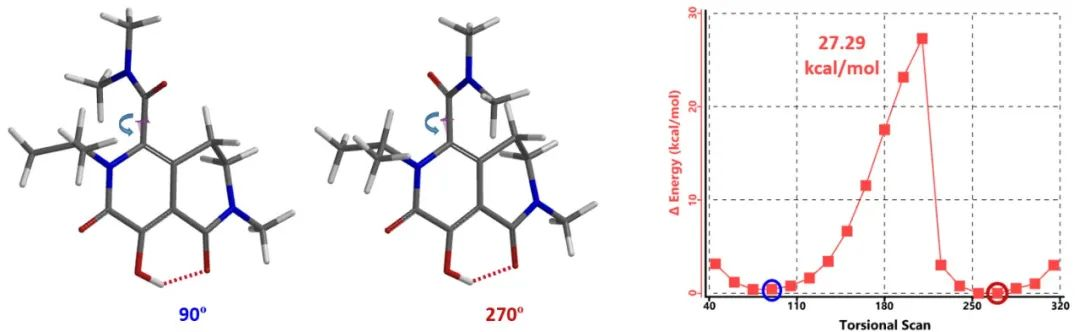
图6. MK-0536旋转扫描能量变化曲线
但是,当MK-0536在人类血浆中,浓度为9 μM时,<30分钟内即可完成相互转化,并且由于相互转化的T1/2太快而无法通过标准方法测量[5]。同样,在狗、大鼠和恒河猴血浆中也观察到相似的快速相互转化。此现象与计算得到的互变能垒为27.29 kcal/mol,T1/2与上述计算并不一致,这就说明血浆/血清加速了阻转异构体的相互转化。因为MK-0536的阻转异构体在人类血浆中会快速互变,以混合物的形式存在,所以在开发MK-0536时,并不需要将阻转异构体进行分离。
上述实验提醒我们对于处于第2类的阻转异构体,在手性SFC分离后,我们仍需要测定它们在血浆/血清中的相互转化速率,来决定开发药物时的策略。
本章节我们通过QM扭转扫描计算阻转异构分子间的互变能垒,可以指导药物化学家在设计药物分子时提前判断两个阻转异构体的稳定性。同时,也要注意不同环境对阻转异构体之间相互转化速率的影响,从而对最终化合物是否进行手性分离做出正确判断。
本期我们也留了一个相似的案例供大家思考:图7中的化合物A也具有类似的阻转异构现象。我们在这里提供了该分子的扭转扫描能量变化曲线。大家可以思考一下为什么扭转扫描能量变化曲线的两边是不对称的?请根据计算所得的能垒,判断该化合物是属于哪一类的阻转异构体?是否需要进行手性SFC分离?
本文由王浩薇、沈小莉、潘东、赖光华、卫小文编撰。
参考文献:
[1] https://cen.acs.org/pharmaceuticals/drug-development/Giving-atropisomers-another-chance/96/i33.
[2] S.T. Toenjes, J.L. Gustafson, Future Med. Chem. 2018, 10, 409. doi.org/10.4155/fmc-2017-0152
[3] S.R. LaPlante, L.D. Fader, K.R. Fandrick, D.R. Fandrick, O. Hucke, R. Kemper, S.P.F. Miller, P.J. Edwards, J. Med. Chem. 2011, 54, 7005.
[4] S.R. LaPlante, P.J. Edwards, L.D. Fader, A. Jakalian, O. Hucke, Chem. Med. Chem. 2011, 6, 505.
[5] M.S. Egbertson, J.S. Wai, M. Cameron, R.S. Hoerrner. Discovery of MK-0536: A Potential Second-Generation HIV-1 Integrase Strand Transfer Inhibitor with a High Barrier to Mutation in Antiviral Drugs: From Basic Discovery through Clinical Trials, W.M. Kazmierski, Ed.; Wiley: Hoboken, New Jersey, 2011, Chapter 12, pp 167-8.
[6]Y. Shi, M.H. Huang, J.E. Macorb, D.E. Hughes, J. Chromatogr. A, 2005, 67, 1078.