网站维护
系统内容更新/升级中

在第一章《亲核反应中LUMO计算的应用》的“小试牛刀”部分中我们留下了一个问题:如果将化合物A中5位的甲基替换成溴、氯、三氟甲基或三氯甲基时,脂肪胺的亲核反应会发生在哪一个碳原子上呢?今天我们就来公布答案(表1),并为大家介绍LUMO的进阶应用!
先介绍一下今天的主角之一:LUMO+1。
LUMO+1轨道就像是LUMO的一个表亲,是能量次低的未占轨道。一般来说LUMO+1能级和LUMO能级有一定的能量差,所以我们在预测亲核反应时,一般都是优先考虑能量最低的LUMO轨道。但是当LUMO+1轨道的能量与LUMO轨道相对接近时,会对反应结果产生怎样的影响呢?
让我们通过对上述反应的预测与解析,来回答这个问题。
首先我们来回溯一下第一章的分析过程。
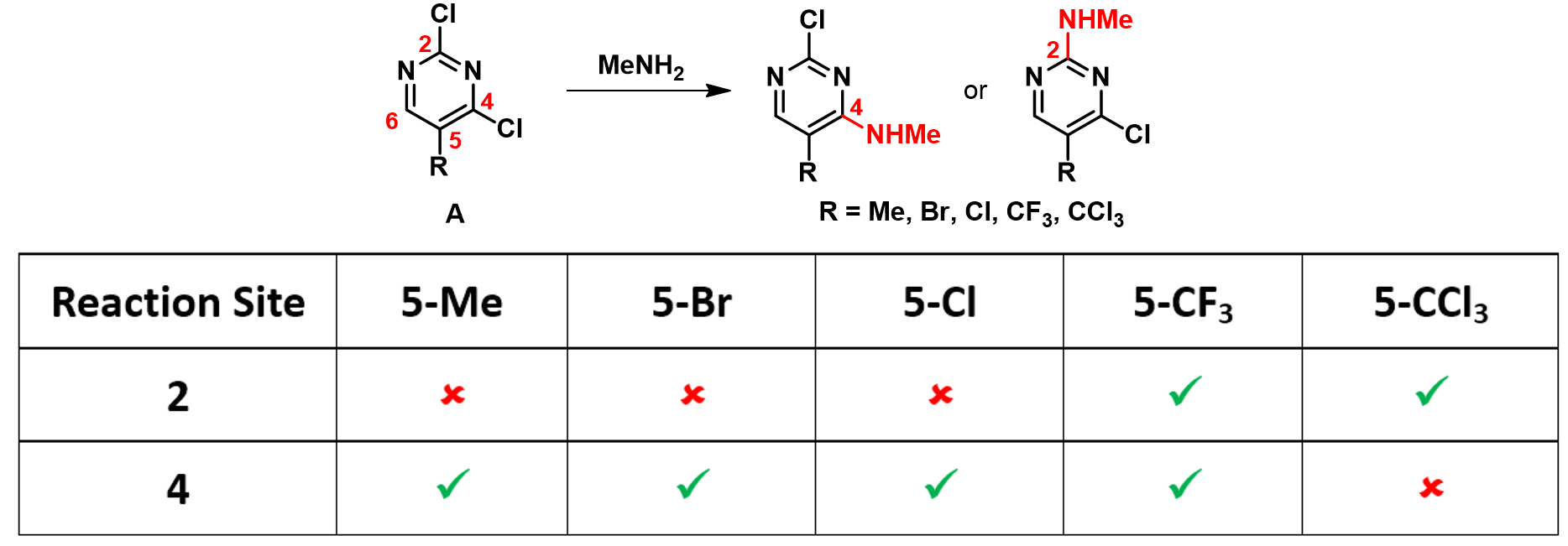
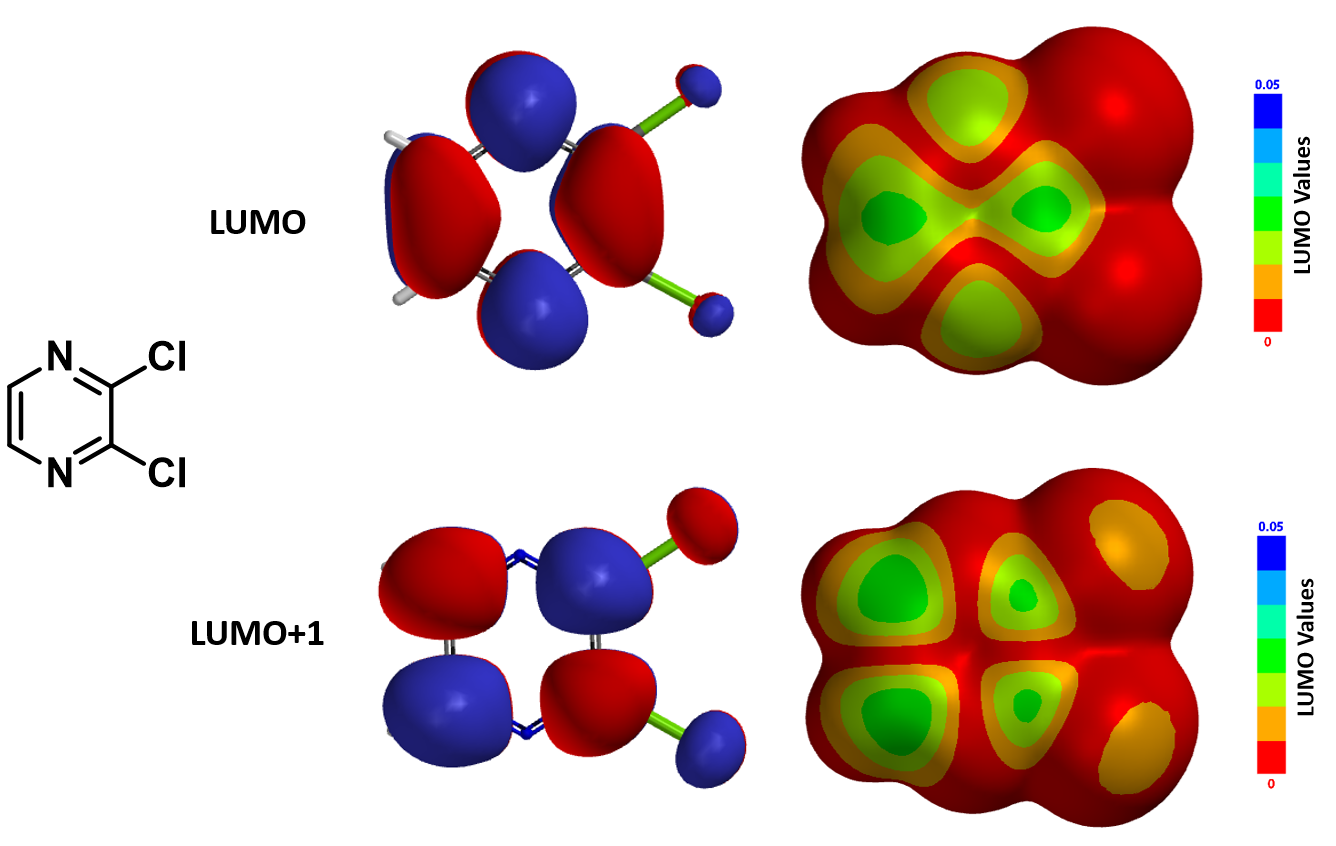
从图1所示的LUMO/LUMO+1的能级与轨道图中可以看到,当C5位是甲基时,LUMO显示C2位无lobe覆盖,而C6位和C4位都有LUMO lobe,均会参与亲核反应。但由于胺对C6位的烷基化过程是可逆的,因此只会得到C4位的产物。将C5位的甲基换成氯或溴时,LUMO轨道的分布相似,同时LUMO与LUMO+1的能量差也都较大,因此我们只需要考虑它们的LUMO,并推测5-Br和5-Cl的化合物A均会选择性地发生C4位亲核取代。
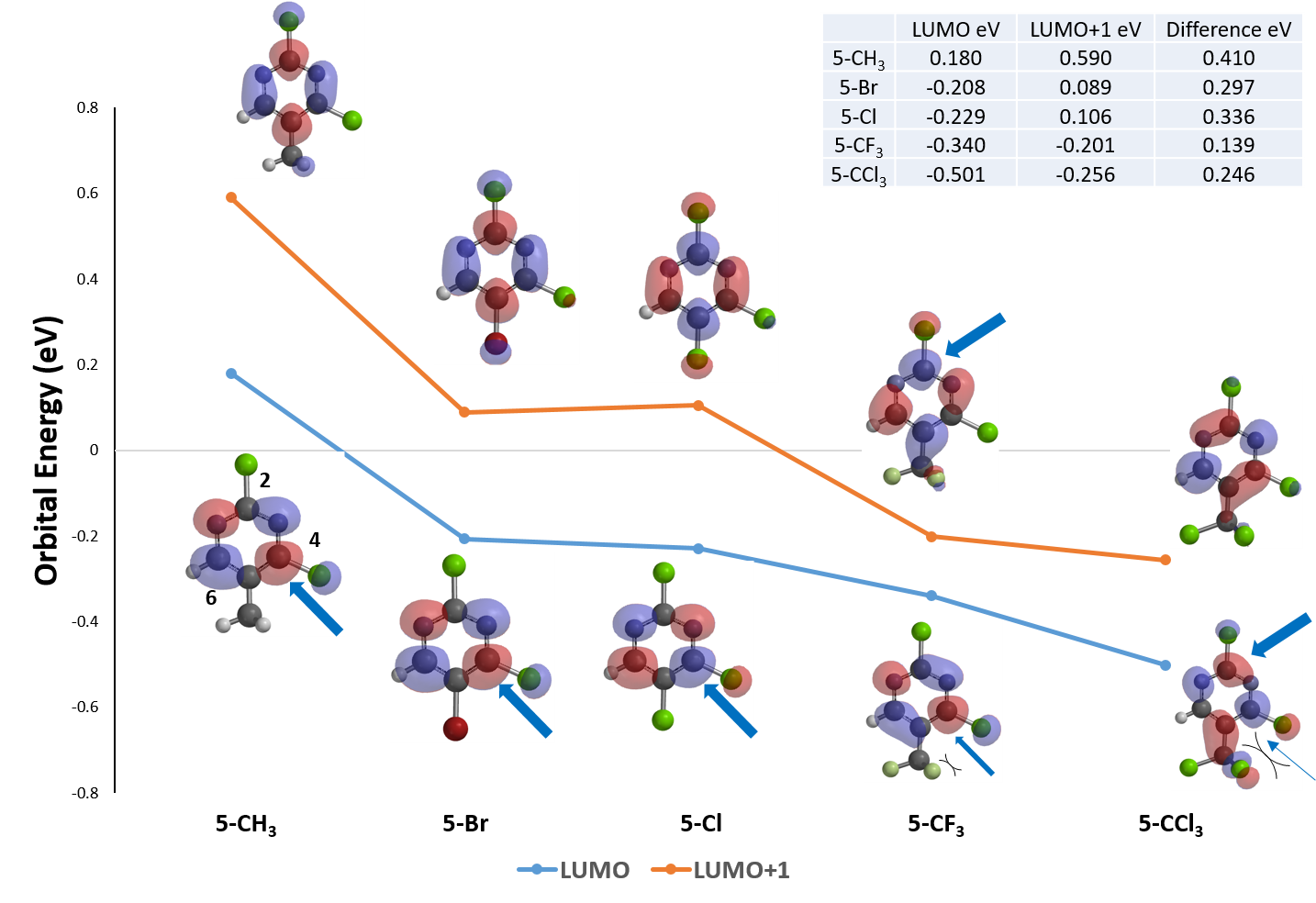
当C5位的取代基变成三氟甲基时,LUMO轨道的分布较之前的三种取代基发生了明显变化。其中LUMO lobe延伸到了C2上,表明 C2也开始有参与亲核反应的可能性。这个底物还有两个独特之处:首先,LUMO与LUMO+1能级的能量差很接近,需要进一步参考LUMO+1能级——我们可以看见在该能级下C2上亦有明显的lobe覆盖;其次,三氟甲基和进攻C4位的亲核试剂存在空间位阻效应。因此我们推测5-CF3的化合物A会丧失亲核取代的选择性,同时获得C2和C4位的取代产物。
当C5位的取代基变成三氯甲基时,LUMO与LUMO+1的能级差再次扩大,我们优先考虑LUMO能级。此时,C6位已经没有LUMO lobe,仅剩C4和C2位参与亲核反应。5-CCl3对C4位的位阻效应会比5-CF3更明显,因此推测我们很可能只会获得C2位的亲核取代产物。
在这一系列的例子中,可以看到QM运算会充分考虑不同取代基对杂环产生的影响,并体现在分子轨道的分布与能级差的变化上。通过有针对性地考察LUMO和LUMO+1,我们就能很好地解释以及预测,二氯嘧啶或类似化合物参与亲核取代反应时的选择性问题。
根据LUMO分子轨道的分布,我们可以判断亲核反应优先发生的位点,以此为依托,还能进一步推测出更合理的反应机理。
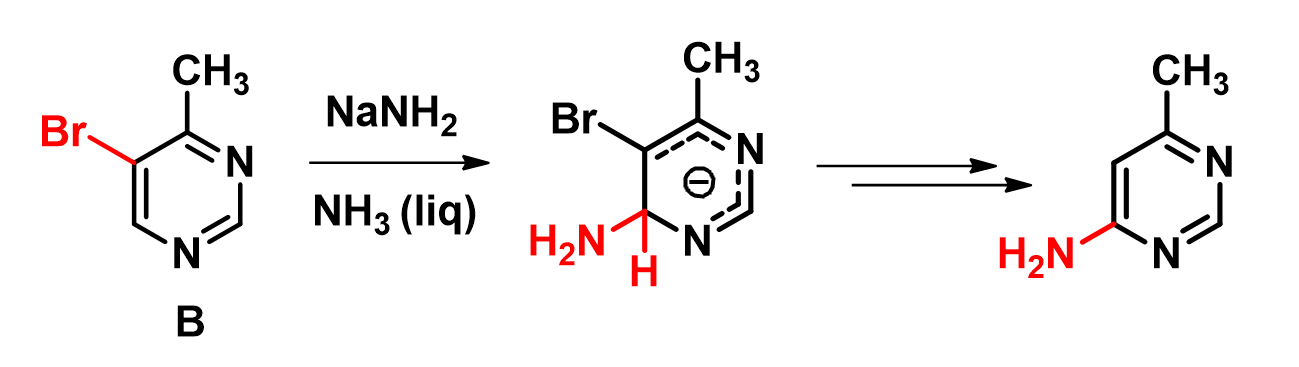
在大学教材"杂环化学"第二版中,作者为了解释化合物B的氨基化反应[1],提出了一个如下图2所示的机理:首先在强碱作用下消去溴化氢,并进一步攫氢形成苯炔阴离子;然后氨基钠对苯炔进行亲核加成,得到最终的氨基嘧啶产物。

熟悉有机化学的你会不会有一种不合理的感觉?一个氨基负离子进攻一个含有负离子的活性中间体?那么,是否能有更加合理的机理解释这个反应呢?以下,让我们借助量子化学计算,尝试寻找一个更合理的解释。
这一案例同样是一个亲核反应,让我们先看一下底物本身的LUMO和LUMO map:
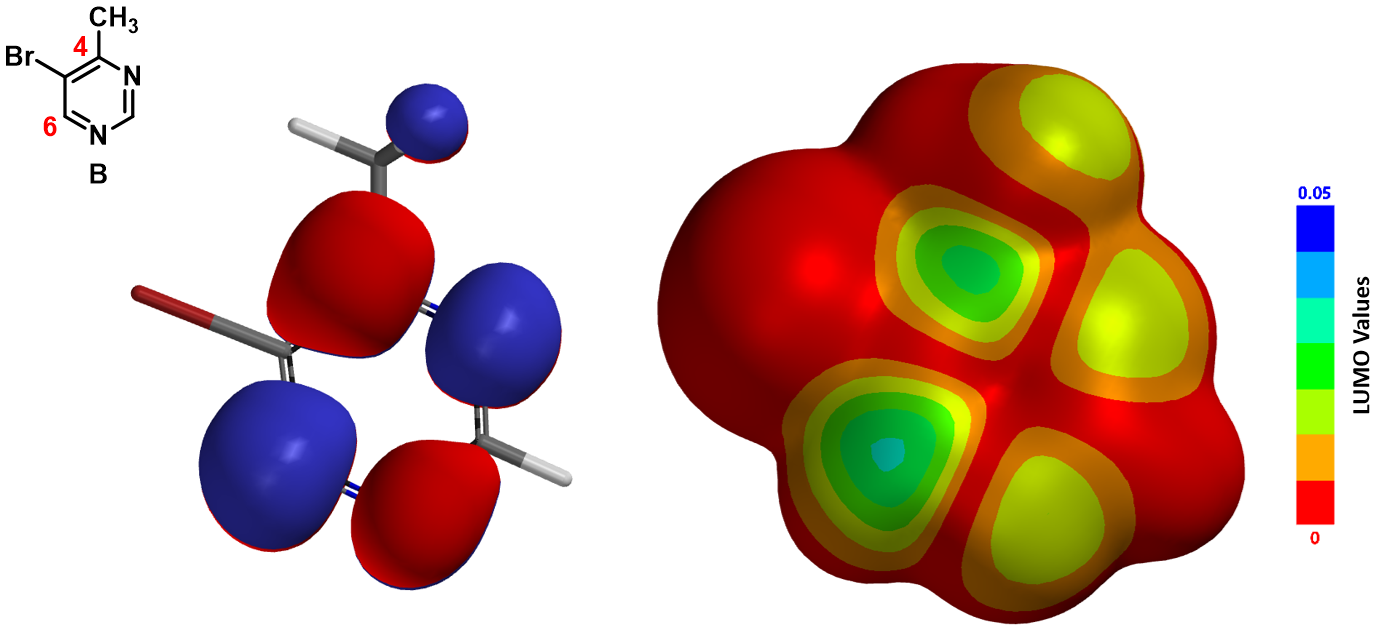
我们可以很清晰地看到,化合物B的LUMO lobe只覆盖了C4和C6位,和溴原子相连的C5上并不存在LUMO lobe。而LUMO map告诉我们,C6位LUMO lobe更易接近,被亲核进攻的概率更大。因此,氨基负离子容易加成在化合物B的C6位上。基于此,我们可以提出一个更合理的反应机理:生成氨基负离子中间体、离去溴化氢得到最终产物,如图4所示:
总结一下,对于较为复杂的亲核取代反应的底物,我们可以优先通过QM计算考虑底物的LUMO lobe分布。当LUMO+1能量与LUMO接近时,需要同时考察LUMO+1 lobe。同时,综合考虑底物的空间效应,参考底物本身的LUMO map,不仅可以帮助我们合理预测反应的发生位置,还可以让我们更准确地理解反应机理。
本期我们继续留一个案例供大家思考:
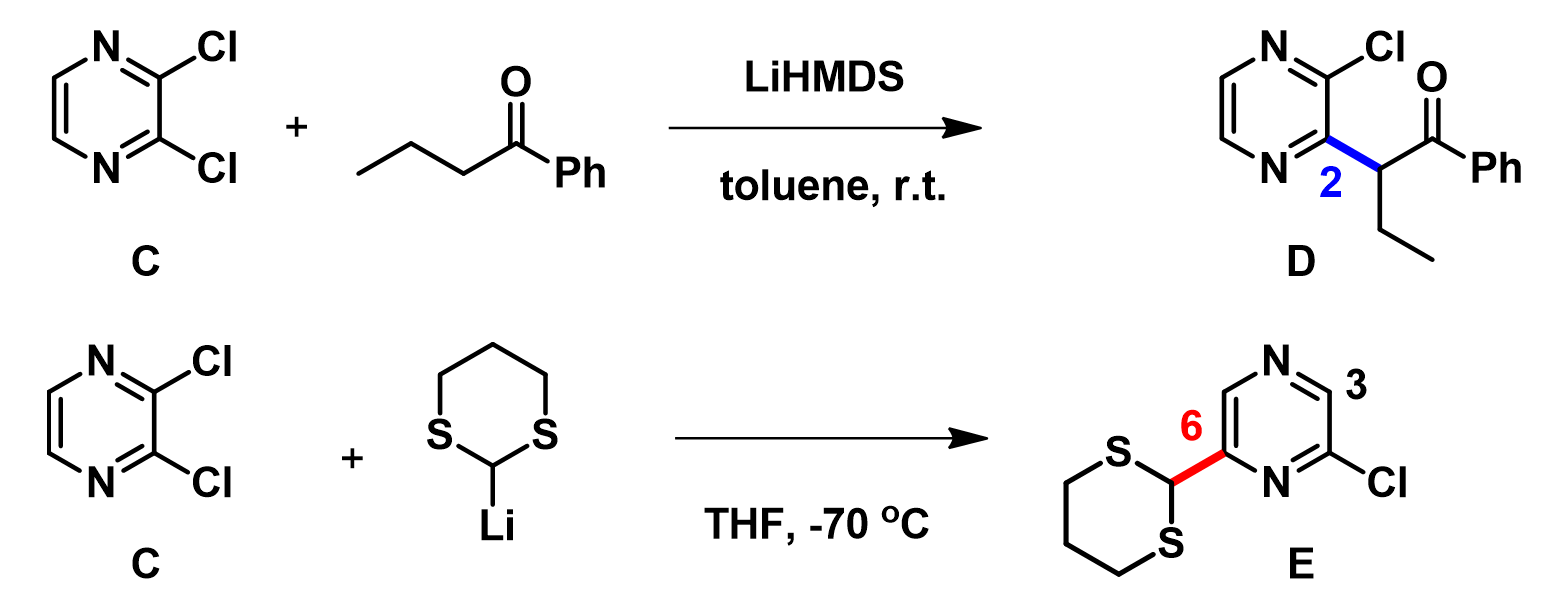
大家知道,化合物C和锂化的苯丁酮化合物反应会得到C2位亲核取代的产物D。但McDonald等人在2006年的一篇发表在TetrahedronLetters上的文献[2]报告了化合物C与锂化二硫缩醛,通过远程取代(tele-substitution)反应,生成了C6位甲酰基取代的2-氯吡嗪化合物E。在此我们给出化合物C的LUMO/LUMO+1和LUMO map/LUMO+1map的图示,聪明的你一定可以推测一下上述实验结果背后的原因!
温馨小提示:
下一章我们会介绍哈蒙德假说!记得来学习探讨哦!
本文由郑重、石谷沁、潘东、王秋月、卫小文编撰。
参考文献:
[1] J. A. Joule & G. F. Smith (1972). Heterocyclic Chemistry 2nd Edition. Page 131.
[2] J. E. Torr, J. M. Large, P. N. Horton, M. B. Hursthouse and E. McDonald. Tetrahedron Lett. 2006, 47, 31-34.