网站维护
系统内容更新/升级中

在前面的第十章中,我们探讨了如何利用QM工具预测多卤代芳香底物亲核取代反应位点及反应优先顺序[1]。今天,我们将再使用QM来对4-硝基苯腈芳香亲核取代反应的机理进行解释。
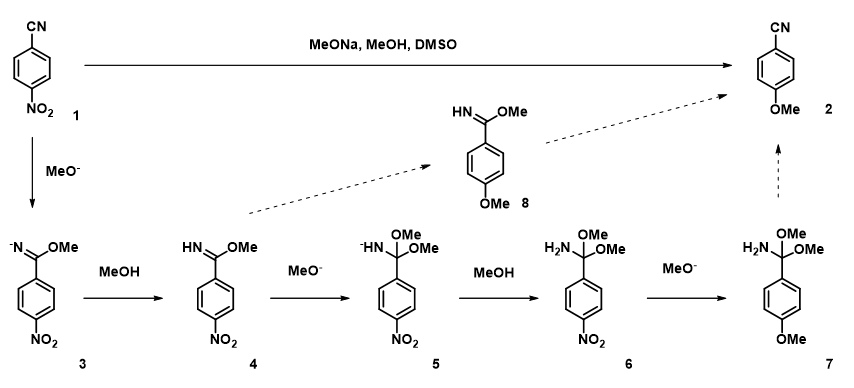
芳香亲核取代反应(SnAr反应)是出现在我们平时合成工作中的高频反应。通常我们认为这类反应易操作、产物单一,但是在我们实际工作中发现一些看似极易发生的SnAr反应在不同的合成人员所得到的结果却大不相同。最近,我们查阅文献时发现2019年发表于ChemRxiv上的文章对4-硝基苯腈(1)芳香亲核取代反应(图1)进行了深入研究,作者发现[2]:
1.只加入一个当量的甲醇钠固体时,根本无法得到目标产物2;
2.大大提高甲醇钠固体的当量能够提升目标产物的收率,但是即使甲醇钠的用量提升到十个当量还是有30%的原料无法完成转化;
3.反应中加入少量甲醇能够显著提升反应收率;
4.当加入甲醇的量超过四十个当量后,反应收率会急剧下降。
在这一章我们将用QM来推测此反应的反应历程,并对上述实验现象尝试做出合理的解释。
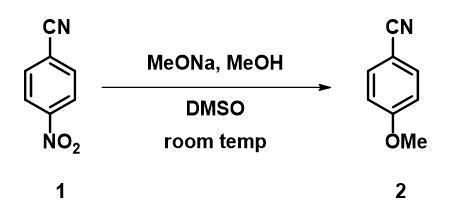
在计算出1的LUMO轨道图的基础上 (图2), 我们首先计算硝基相连苯环碳原子 (C4) 发生亲核加成过程中能量变化。通过计算结果,我们能够得到两个显而易见的结论 (图3):1. 甲氧基负离子从3.4 Å到2.5 Å接近C4碳原子的过程存在着6.06 kcal/mol 的能量降低。2. 整个亲核加成的过程仅有相对较低的2.59 kcal/mol能垒, 与观察 1 不一致。
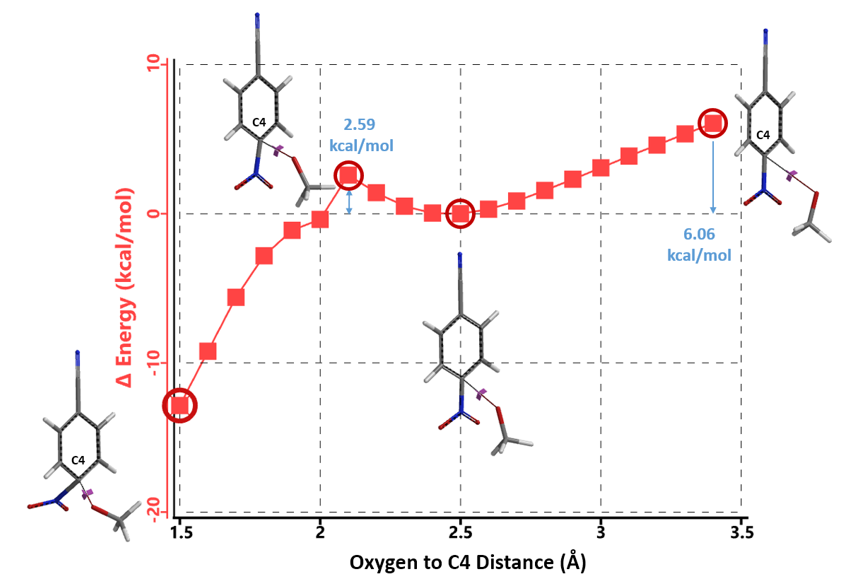
随后我们对氰基相连苯环碳原子(C1)发生亲核加成过程中能量变化进行了计算(图4)。虽然计算模拟的是甲氧基负离子进攻C1碳原子的过程,但是我们发现在从3.4 Å 到 2.4 Å接近C1碳原子的同时,甲氧基负离子也以3.25 Å到1.48 Å的距离接近氰基碳原子。1.48 Å的距离与碳氧共价单键的长度十分接近,此过程可以被认为是甲氧基负离子中的氧原子与氰基碳原子成键的过程。同时氰基与C1碳之间的键角也从176.5º变为127.2º,可以被视作氰基的碳氮三键向亚胺酯的碳氮双键转化的过程。而且此过程还伴随着18.87 kcal/mol的能量降低,表明甲氧基负离子更倾向先与氰基碳原子生成苯亚胺酯。后续从苯亚胺酯转化为目标产物4-甲氧基苯腈2这一过程(2.4 Å到1.5 Å),则需要完成在室温反应条件下无法实现的高达35.93 kcal/mol的能垒跨越。
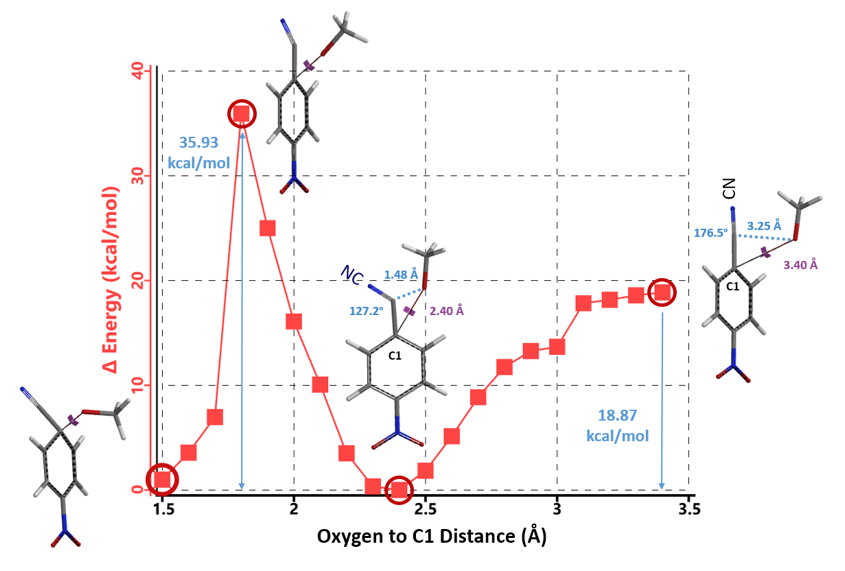
根据上述计算结果,我们推测苯亚胺酯极有可能是此反应历程中一个重要的中间体,所以计算产生此中间体过程的能量变化是十分必要的。通过计算,我们发现生成苯亚胺酯的反应历程与C4位硝基被取代的历程相似,此历程的反应能垒相比硝基被取代2.59 kcal/mol更低,仅有0.78 kcal/mol (图5)。
通过对三个反应历程进行能量变化的计算后,我们能够得出初步结论:第一分子的甲醇钠首先会进攻氰碳原子得到活性中间体3,但并不能直接得到目标产物2。此结论与实验者观察到的只加入一当量的甲醇钠时,无法得到目标产物的实验现象相符。
接下来我们对反应中产生的中间体的LUMO进行了计算,结果如图6所示:4-硝基苯腈被甲醇钠进攻得到的负离子中间体3的LUMO能量为2.74 eV,表明此中间体的亲电性是较弱的。当此负离子中间体3与甲醇发生质子交换后得到中性中间体4, 其LUMO能量为 -0.85 eV,恢复了较强的亲电性,能够进行第二次亲核加成反应。这个计算结果表明4-硝基苯腈与第一分子的甲醇钠反应生成的负离子中间体3需要进行质子交换来重新获得较强的亲电性以继续后续亲核加成反应。此结论也与实验中所观察到的适量甲醇的加入能够提升反应收率的实验现象相吻合。
为了弄清第一次亲核反应生成的苯亚胺酯中间体4继续与甲醇钠反应的反应历程,我们分别计算第二分子的甲醇钠进攻苯亚胺酯碳原子和取代C4位硝基的反应的能量变化曲线,结果如图7所示:
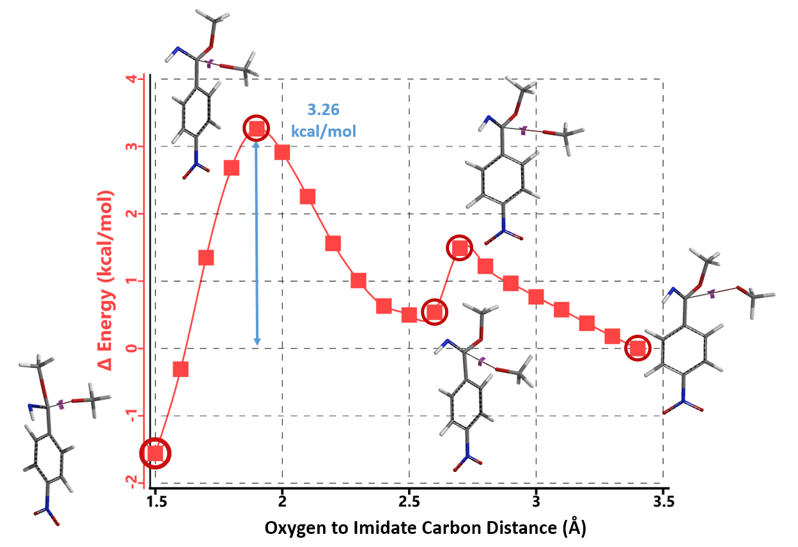
计算结果显示:第二分子的甲醇钠取代硝基的所需活化能(4.54 kcal/mol)比进攻亚胺酯碳原子(3.26 kcal/mol)高1.28 kcal/mol,所以第二次亲核加成反应更倾向于发生在苯亚胺酯碳原子形成新的负离子中间体5(图9),与苯亚胺酯中间体3类似,此中间体同样与甲醇进行质子交换后形成中性中间体6 (LUMO energy -0.67 eV),此中间体仍然具有较强的亲电性,能够再一次进行亲核加成。从计算结果看出,4-硝基苯腈与第二分子的甲醇钠反应得到活性中间体6,仍然没有进行硝基的取代, 所以我们还需要对第三次亲核加成的反应历程进行探索。
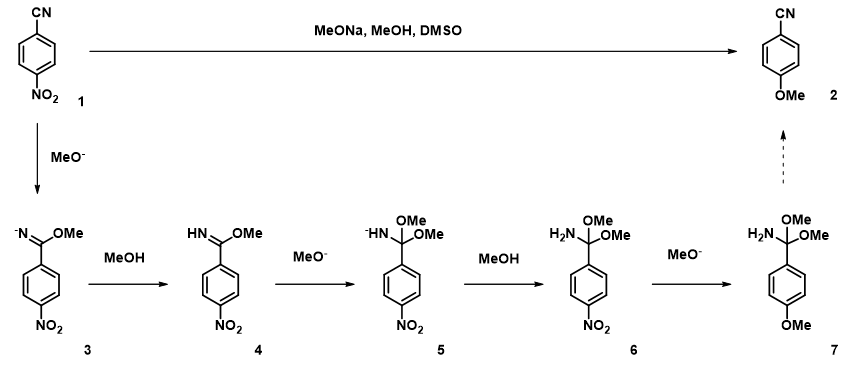
在对前两次亲核加成反应计算的基础上,我们计算第三分子甲醇钠取代硝基的能量变化曲线,从计算结果(图10)可以看出:此过程在2.1 Å和1.8 Å出现了两个能量峰。
为了更清楚的了解此反应历程,我们在1.6 Å到2.4 Å这一区间对此反应的能量变化进行精确(步长0.05 Å)的计算(图11)。此计算结果使我们在2.15 Å和1.85 Å 得到了两个可能的过渡态,通过进一步计算我们发现只有在1.85 Å 的结构存在一个虚频 (图12, i331 cm-1),表明这个活化能为5.59 kcal/mol 的中间体就是此反应决速步的过渡态[3]。
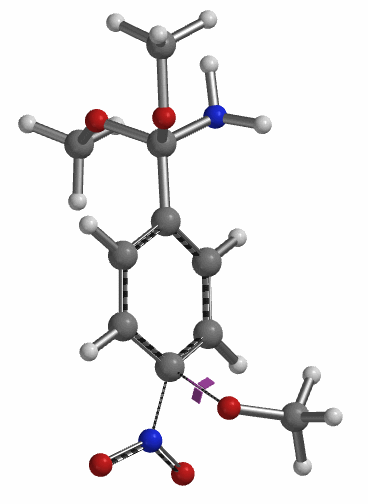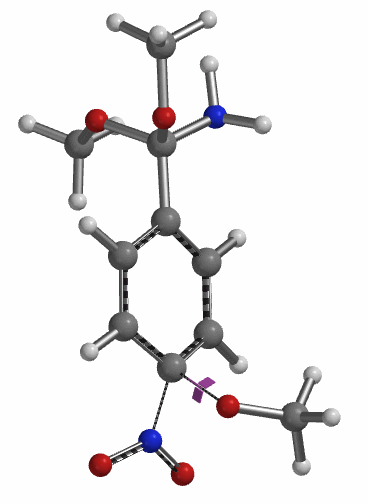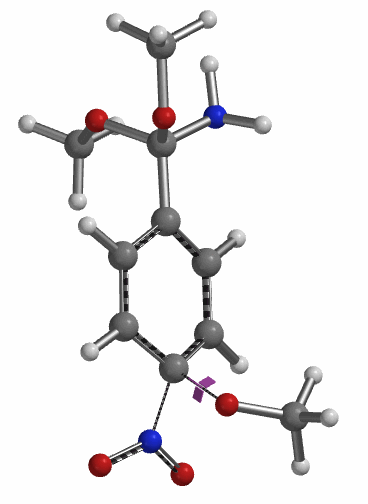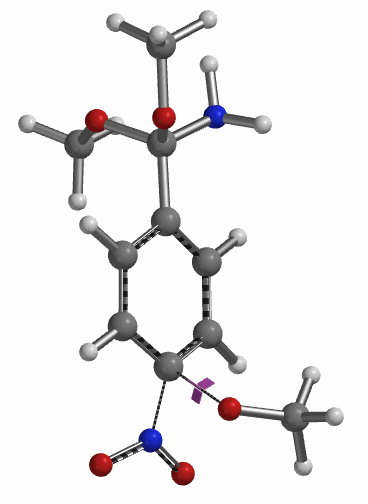
至此,完成了第三分子甲醇钠取代硝基过程的计算后,我们能够推测出整个4-硝基苯腈芳香亲核取代的反应历程:如图13所示:第一分子的甲氧基负离子进攻氰基碳原子得到亚胺酯中间体3,随后此离子中间体与甲醇发生质子交换后得到亲电活性中间体4,此中间体再重复一次甲氧基负离子进攻/甲醇质子交换的过程得到中间体6,中间体6与第三分子的甲醇钠发生硝基的取代反应,随后得到目标产物4-甲氧基苯腈(2)。另外在得到活性中间体4后,由于甲氧基负离子进攻4中的亚胺酯碳原子与取代硝基的活化能差距不大(△△E=1.28 kcal/mol),所以不能排除也有小部分中间体4经过8得到目标产物2。
为什么我们想要解释这一反应现象呢,因为这类SnAr反应在实际工作中有较高的应用频率,然而看似极其简单的反应,不同合成人员重复起来常常得到很大的差异的结果。通过QM我们推测出此类反应可能经历了较复杂的反应历程,其中任何一个细节如:反应试剂的规格(固体粉末还是某种溶剂的溶液)、反应试剂的当量数(反应过程中是否进行补加)、反应溶剂的质量(普通溶剂、超干溶剂、含水溶剂)等等都会对最后的产率造成极大的影响。所以,详尽准确的实验记录和严格按照实验记录来开展实验在重复此类反应时是十分重要的!
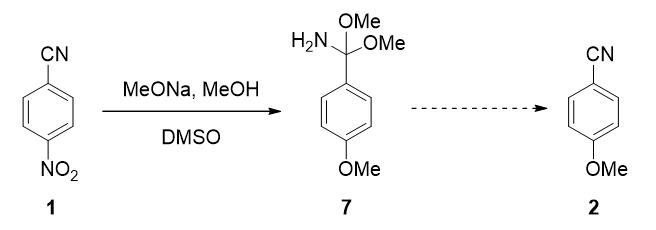
经过计算,我们可以推测出4-硝基苯腈的芳香亲核取代需要经过中间态7,那么中间态7又是经历了怎样的反应历程得到我们的目标产物4-甲氧基苯腈(2)呢?经过水解或再与第四分子的甲醇钠反应生成目标产物2[4]?
本文由王雨、陈永胜、卫小文编撰。
参考文献:
[1] QM有机化学课堂第七章《LUMO运用进阶如何预测亲核反应选择性》
[2] Ma Y. Solvent Molecules Play a Role in an SNAr Reaction. ChemRxiv. Cambridge: Cambridge Open Engage; 2019; 10.26434/chemrxiv.7782797.v1
[3] Spartan'20 Tutorial and User's Guide (2020). Irvine, CA, USA: Wavefunction, Inc. pp. 158, 442, 459 & 536 及QM有机化学课堂第二十二及二十四章有关过渡态和虚频的计算。
[4] 需要考虑:1,后处理:反应混合物用NaHCO3水溶液淬灭,二氯甲烷萃取。2,苯亚胺酯与水反应生成苯酰胺。3,4-硝基苯腈完全转化为4-甲氧基苯腈,没有检测到副产物。