网站维护
系统内容更新/升级中

双功能分子突破了传统成药原则,使攻克“不可成药的”靶点成为了可能。通过将两种蛋白质结合在一起,具有这种新模式的分子可以调节降解、信号传导、蛋白质折叠等传统小分子难以控制的细胞事件。然而,作为一种新模式分子,双功能分子在面临挑战的同时,也继续从新工具的开发和应用中获益。
“双功能分子”涵盖了具有不同但相似策略的相关模式的集合。一些作为“分子胶水”的小分子被认为是双功能化合物,包括免疫调节药物 (IMiDs) 如沙利度胺(thalidomide)和来那度胺(lenalidomide),这些分子可与 E3 连接酶相互作用,促进靶蛋白的降解。
然而,双功能分子通常具有比“分子胶水”更复杂的结构。其中一类分子就是目前备受关注的蛋白降解靶向嵌合体(PROTAC®)。这些分子由具有靶向目标蛋白功能的小分子、具有招募E3连接酶的配体和连接这两个配体的连接体组成。尽管PROTAC在结构上不同于“分子胶水”,它们却有相似的作用。PROTAC分子通过将目标蛋白和E3连接酶拉近,导致目标蛋白泛素化,被泛素化的目标蛋白随后被蛋白酶体降解。
双功能分子设计的广度为药物的一系列应用创造了新机会。这些以连接体为主要组成的分子可影响免疫系统方向,作用于转录延伸并抑制蛋白质-蛋白质相互作用(PPI)。双功能分子还可以进一步调节相互作用,或抑制转运蛋白功能。
越来越多的证据表明,PROTAC与其他模式相比具有一定的优势。研究人员发现PROTAC比其组成部分具有更大的选择性,能够优先降解目标蛋白。例如,激酶靶标中的小分子配体通常选择性较低,当构建成PROTAC后,他们的选择性更高,仅触发有限的激酶的降解。
其他研究表明 PROTAC可以克服靶蛋白活性位点的点突变,表明这类分子具有作为对其他治疗药物产生耐药性患者的二线疗法的潜力。然而,PROTAC能否靶向作用于使特定蛋白耐药的突变仍有待观察。
与任何其他模式一样,研究人员在设计双功能分子时需要深入了解一个分子的选择性及其对后阶段的影响。有益蛋白的意外标记和降解可能导致负面结果,IMiDs的经验表明,稳定配体-蛋白质相互作用会引起一系列的临床效果,其中只有一些是有益的。
识别和研究双功能分子带来了新的挑战。PROTAC把研究人员的目光从熟悉的化学“5 规则(rule of 5)”转移到至少能与两种蛋白结合的多组分分子,来独立且综合地理解分子间的生物物理功能是如何驱动这一过程的。面对这些新的挑战,研究人员正在开发新型的检测技术,以了解双功能分子的行为以及它们自身和与同源蛋白复合时的 3D 结构。
成功的双功能分子的研发需要掌握多种技术和工作流程。该过程的早期步骤是使用 DNA 编码化合物库(DEL)来鉴定靶向蛋白的结合体。DEL 策略使研究人员能够合成和筛选多达万亿 DNA 标签分子的化合物库。将化合物库暴露于目标蛋白,并对所有分子的DNA条形码进行排序,从而显示与靶蛋白的亲和力,鉴定新的配体。
基于片段的药物设计 (FBDD) 是鉴定目标蛋白新配体的另一个有效工具。FBDD 利用低分子量片段开发高亲和力化合物,这使得采用相对较少的分子覆盖广泛的化学空间成为可能。在针对非传统药物靶点的背景下,这种利用生物物理技术优化低亲和力配体的能力尤其重要。
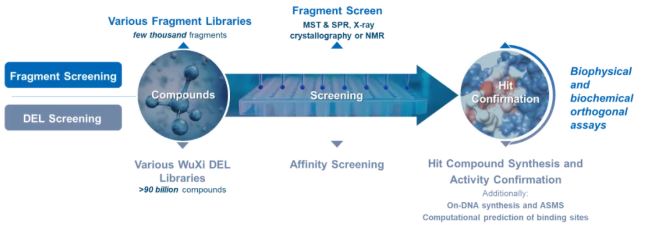
亲和选择质谱 (ASMS) 是另一种结合驱动的检测方法,也是研发工具包的关键部分。ASMS可以评估大量候选分子与靶蛋白的结合,以快速鉴定那些表现出亲和力的分子。
这些基于亲和力的筛选平台能够鉴定中高亲和力配体。与经典药理学不一样,靶蛋白配体或 E3 连接酶配体都不需要功能活性。利用计算化学平台优化配体-靶标相互作用和连接体设计,可成功地对单个配体或双功能分子进行了进一步优化。
双功能分子(如 PROTAC)的优化和表征通常使用生物物理测试平台,结合结构生物学进行。微尺度热泳动 (MST) 和表面等离子体共振 (SPR) 等技术常用于研究配体的结合和双功能分子的结合,以及测量三元复合物(连接酶 + 靶蛋白 + 双功能分子)结合的协同性。
结构生物学的评估可以通过蛋白质 X 射线晶体学及冷冻电镜(CRYO-EM)来实现。利用这些技术揭示高分辨率的三元复杂晶体结构可以促进复杂分子的合理化及高效优化。通过采用这些技术,研究人员已经开发了先进的双功能分子,这些分子有可能满足那些未被满足的医疗需求。
未来,我们有希望在目前已取得成果的基础上再接再厉。扩展连接酶库,以纳入具有不同底物图谱、不同时间和空间的表达谱,可以对具有不同有效性和安全性特征的分子进行鉴定。我们需要新的工具来推动进一步的发展,这项工作的回报将是显著的。
迄今为止,被预测可成为 E3 连接酶基因家族成员的 600 种左右的蛋白质中,只有少数被用于产生PROTAC 分子。大量的连接酶类,如 RING 结构域 E3 连接酶在很大程度上仍然未被探索,这说明靶向候选底物蛋白的细胞类型选择性或组织选择性具有潜在的新机会。例如,CDC20 是细胞分裂的调节因子,对所有癌症类型都是必需的,但在大多数人体组织中仅低水平表达。对 RING 结构域 E3 连接酶 APC的研究可以为降解 CDC20 提供新的机会。
PROTAC 的研究也可以通过靶向 E3 连接酶 HECT 家族的其他成员来推进,E3 连接酶包括与泛素形成硫酯键的酶。研究已经将 HECT E3 连接酶与癌症、心血管疾病和神经系统疾病联系起来,这为药物开发者创造了新的路径。
此外,除了泛素化,还可以“劫持”其他细胞过程以驱动目标蛋白的降解。例如,溶酶体靶向嵌合体(Lysosome targeting chimera,LYTAC),利用聚糖标签来标记靶蛋白,并利用受体介导胞内溶酶体降解靶蛋白。通过利用溶酶体途径,LYTAC有望能够驱动细胞外和对细胞内蛋白有耐药性PROTAC的膜结合蛋白的降解。
研究人员也开始探索自噬靶向嵌合体(Autophagy-targeting chimera,AUTAC)和自噬体绑定化合物(Autophagosome-tethering compound,ATTEC)的潜力。AUTAC与 PROTAC一样,利用泛素化驱动靶蛋白的降解。然而,AUTAC触发了一种不同形式的多聚泛素化,被选择性自噬途径识别。相反,ATTEC会直接将靶蛋白与吞噬体或自噬体绑定,使蛋白降解,不涉及泛素化。
随着对细胞内和细胞外降解途径的深入了解,双功能分子的机会越来越多。在对PROTAC 的工具和技术打磨后,研究人员将更有能力将通路知识转化为新药。
利用快速识别亲和力配体的工具,表征动力学作用的技术和促进计算机模拟设计技术的结构信息,研发人员正准备发现和开发一系列双功能分子,以解锁以前无法获得的生物学知识。该领域与所有新兴的药物开发领域一样,将面临挑战和挫折,但迄今为止取得的进展表明双功能分子具有满足未被满足的医疗需求的潜力。
PROTAC®is aregistered trademark of Arvinas Operations, Inc., and is used under license